题目内容
常温常压下,某烧碱溶液与0.05mol氯气恰好完全反应,得到pH=9的混合溶液(溶质为NaCl与NaC1O).下列说法正确的是(NA代表阿伏伽德罗常数)( )
| A、氯气的体积为1.12L |
| B、原烧碱溶液中含溶质离子0.2NA |
| C、所得溶液中含OH-的数目为1×10-5NA |
| D、所得溶液中C1O-的数目为0.05NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据气体摩尔体积的条件应用分析判断;
B、原烧碱溶液中溶质为氢氧化钠,0.05mol氯气和0.1mol氢氧化钠恰好反应分析;
C、依据离子积常数结合pH计算分析;
D、次氯酸根离子水解.
B、原烧碱溶液中溶质为氢氧化钠,0.05mol氯气和0.1mol氢氧化钠恰好反应分析;
C、依据离子积常数结合pH计算分析;
D、次氯酸根离子水解.
解答:
解:A、常温常压下,某烧碱溶液与0.05mol氯气恰好完全反应,不是标准状况,氯气体积不是1.12L,故A错误;
B、原溶液中溶质为氢氧化钠,Cl2+2NaOH=NaCl+NaClO+H2O,0.05mol氯气和0.1mol氢氧化钠恰好反应,所以原烧碱溶液中含溶质离子0.2NA,故B正确;
C、得到pH=9的混合溶液,氢氧根离子浓度为10-5mol/L,溶液体积不知不能计算微粒数,故C错误;
D、次氯酸根离子水解,所得溶液中C1O-的数目小于0.05NA,故D错误;
故选B.
B、原溶液中溶质为氢氧化钠,Cl2+2NaOH=NaCl+NaClO+H2O,0.05mol氯气和0.1mol氢氧化钠恰好反应,所以原烧碱溶液中含溶质离子0.2NA,故B正确;
C、得到pH=9的混合溶液,氢氧根离子浓度为10-5mol/L,溶液体积不知不能计算微粒数,故C错误;
D、次氯酸根离子水解,所得溶液中C1O-的数目小于0.05NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的分析判断,主要是盐类水解的分析,化学方程式的计算应用,题目难度中等.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2?2(t-BuNO).在20℃时,向2L正庚烷中加入(t-BuNO)2 1.0mol,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2L).下列说法正确的是( )
| A、反应在前10min内的平均速率为ν(t-BuNO)=0.0375mol?L-1?min-1 |
| B、保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)2的方向移动 |
C、保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,则其能量关系可用图表示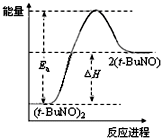 |
| D、保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率大于75% |
通过NOx传感器可监测NOx的含量,其工作原理示意图如图,下列说法正确的是( )
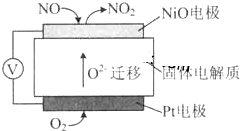

| A、NiO电极是该电池的正极 |
| B、Pt电极附近的pH增大 |
| C、NiO电极的电极反应式:NO-2e-+O2-═NO2 |
| D、固体电解质中O2-向正极移动 |
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池的总反应式为8Li+3SOCl2═6LiCl+Li2SO3+2S,则下列叙述正确的是( )
| A、用该电池电解CuCl2溶液产生2.24L Cl2时,有0.2mol电子转移 |
| B、金属锂作电池的负极,石墨作电池的正极,加入硫酸可提高电解质的导电性 |
| C、电池工作(放电)过程中,SOCl2被还原为Li2SO3 |
| D、电池工作过程中,负极消耗的锂与正极生成的硫质量之比为7:8 |
以下离子方程式的书写正确的是( )
| A、氧化铁和稀盐酸:FeO+2H+=Fe2++H2O |
| B、向NaOH溶液中通Cl2:2OH-+Cl2=Cl-+ClO-+H2O |
| C、向AlCl3溶液中加过量强碱:Al3++3OH-=Al(OH)3↓ |
| D、给漂白粉溶液中加入盐酸:Ca(ClO2)+2H+=2HClO+Ca2+ |
能使反应:Cu+2H2O=Cu(OH)2+H2发生的是( )
| A、铜片作阴、阳极,电解CuCl2 |
| B、铁片作正极,Cu片作负极,CuCl2作电解质溶液的原电池 |
| C、用铜片作阴、阳极,电解NaOH溶液 |
| D、铜锌合金在潮湿空气中发生电化学腐蚀 |

 实验室配制480mL 0.1mol?L-1NaOH溶液,回答下列问题
实验室配制480mL 0.1mol?L-1NaOH溶液,回答下列问题