题目内容
请根据化学反应的有关原理回答下列问题.
(1)现代工业采用甲烷部分氧化法制H2,其反应式为:
CH4(g)+
O2(g)=CO(g)+2H2(g)△H1=-35.6kJ/mol…①
试判断常温下,上述反应能否自发进行? .(选填“能”或“否”).
有研究认为甲烷部分氧化的机理为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H2=-890.3kJ/mol…②
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H3=+247.3kJ/mol…③
试结合反应①确定下面热化学反应方程式中的△H:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H= kJ/mol
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.2mol,n(H2)=1.2mol,n(NH3)=0.8mol,则反应速率
v(N2)= mol/(L?min),H2的转化率= ,平衡常数K= .若保持容器的温度和容积不变,将上述平衡体系中的混合气体均增加0.8mol,则平衡会向 移动(选填“正反应方向”、“逆反应方向”或“不”).
(3)O3氧化脱除燃煤烟气中NO的反应为NO(g)+O3(g)?NO2(g)+O2(g).在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率时间变化的关系如图所示.由图可得出的正确说法是
A.该反应为放热反应
B.反应物浓度:b点小于c点
C.反应在c点恰好达到平衡状态
D.△t1=△t2时,NO的转化量:a~b段小于b~c段
(4)已知当溶液中某种离子浓度小于10-5mol/L时即可看作完全沉淀.现向浓度均
为0.022mol/L的CuSO4、Fe2(SO4)3的混合溶液中加入NaOH溶液,当溶液的pH= 时,Fe3+才能完全沉淀,此时Cu2+是否开始沉淀? (选填“是”或“否”).[已知常温下Cu(OH)2的KSP=2.2×10-20,Fe(OH)3的KSP=1.25×10-36,lg2=0.3]
若要除去上述混合溶液中的Fe3+,可采取的方法是:先向溶液中加入下列物质中的 ,然后过滤.
A.NaOH B.CuO C.Cu(OH)2 D.NH3?H2O.
(1)现代工业采用甲烷部分氧化法制H2,其反应式为:
CH4(g)+
| 1 |
| 2 |
试判断常温下,上述反应能否自发进行?
有研究认为甲烷部分氧化的机理为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H2=-890.3kJ/mol…②
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H3=+247.3kJ/mol…③
试结合反应①确定下面热化学反应方程式中的△H:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.2mol,n(H2)=1.2mol,n(NH3)=0.8mol,则反应速率
v(N2)=

(3)O3氧化脱除燃煤烟气中NO的反应为NO(g)+O3(g)?NO2(g)+O2(g).在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率时间变化的关系如图所示.由图可得出的正确说法是
A.该反应为放热反应
B.反应物浓度:b点小于c点
C.反应在c点恰好达到平衡状态
D.△t1=△t2时,NO的转化量:a~b段小于b~c段
(4)已知当溶液中某种离子浓度小于10-5mol/L时即可看作完全沉淀.现向浓度均
为0.022mol/L的CuSO4、Fe2(SO4)3的混合溶液中加入NaOH溶液,当溶液的pH=
若要除去上述混合溶液中的Fe3+,可采取的方法是:先向溶液中加入下列物质中的
A.NaOH B.CuO C.Cu(OH)2 D.NH3?H2O.
考点:用盖斯定律进行有关反应热的计算,化学平衡的影响因素,化学平衡的计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:化学反应中的能量变化,化学平衡专题,电离平衡与溶液的pH专题
分析:(1)反应的自发性是由熵变和焓变共同决定,若△H<0,△S>0,则一定能自发进行,若△H>0,△S<0,则一定不能自发进行,若△H<0,△S<0或△H>0,△S>0,则可以自发进行,是否自发和温度有关.用盖斯定定律进行反应热的计算,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的.
(2)化学反应速率、转化率和平衡移动有关知识的考查,涉及到三行式的应用.其中在保持容器的温度和容积不变,将上述平衡体系中的混合气体均增加0.8mol,相当于给原平衡体系加压,接下来考虑外界因素对平衡移动的影响.
(3)化学平衡图象题,根据图象开始阶段反应速率逐渐增大,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,所以该反应是放热反应,随着反应的进行,反应物的浓度逐渐减小,c点反应速率还再变化,而不是固定不变,只有不再随时间的变化而变化,才是平衡状态,△t1=△t2时,NO的转化量,看a~b段和b~c段斜率大小.
(4)通过溶度积的表达式,求溶液的PH;离子积和溶度积的相对大小来判断沉定是否形成.除杂是铁离子水解平衡的考查,除杂的同时不能新杂质.
(2)化学反应速率、转化率和平衡移动有关知识的考查,涉及到三行式的应用.其中在保持容器的温度和容积不变,将上述平衡体系中的混合气体均增加0.8mol,相当于给原平衡体系加压,接下来考虑外界因素对平衡移动的影响.
(3)化学平衡图象题,根据图象开始阶段反应速率逐渐增大,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,所以该反应是放热反应,随着反应的进行,反应物的浓度逐渐减小,c点反应速率还再变化,而不是固定不变,只有不再随时间的变化而变化,才是平衡状态,△t1=△t2时,NO的转化量,看a~b段和b~c段斜率大小.
(4)通过溶度积的表达式,求溶液的PH;离子积和溶度积的相对大小来判断沉定是否形成.除杂是铁离子水解平衡的考查,除杂的同时不能新杂质.
解答:
解:(1)在CH4(g)+
O2(g)=CO(g)+2H2(g)△H1=-35.6kJ/mol中,在化学反应中若△H<0,△S>0,则一定能自发进行,若△H>0,△S<0,则一定不能自发进行,若△H<0,△S<0或△H>0,△S>0,则可以自发进行,是否自发和温度有关.而该反应的△S>0,△H<0所以反应一定能自发.故答案为:能
用盖斯定定律进行反应热的计算,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的.通过分析,
目标反应的△H=(4△H1-△H2-△H3)÷2=[-35.6kJ/mol×4-(-890.3kJ/mol)-247.3kJ/mol]÷2=+250.3kJ/mol,故答案为:+250.3kJ/mol.
(2)设起始时n(N2)为xmol,n(H2)为ymol,N2的转化量为amol由方程式可知:
N2 +3H2 ?2NH3
起始量(mol) x y 0
变化量(mol) a 3a 2a
平衡量(mol) x-a 3a 2a
由题意可知:x-a=1.2,y-3a=1.2,2a=0.8,
即:x=1.6mol,y=2.4mol,a=0.4mol,所以反应速率v(N2)=
=0.02mol/(L?min),
H2的转化率为:
×100%=50%,平衡常数K为
=1.23,
其中在保持容器的温度和容积不变,将上述平衡体系中的混合气体均增加0.8mol,相当于给原平衡体系加压,增加压强平衡向正反应方向.
故答案为:0.02mol/(L?min);50%;1.23;平衡向正反应方向;
(3)A.开始阶段反应速率逐渐增大,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,所以该反应是放热反应,故A正确;
B.随着反应的进行,反应物的浓度逐渐减小,所以b点反应物的浓度大于c点,故B错误;
C.根据图象可知c点反应速率还再变化,因此不是平衡状态,故C错误;
D.根据曲线的斜率可知b~c段反应速率快,反应物的转化率大,故D正确.
故答案为:AD;
(4)当Fe3+完全沉淀时,C(OH-)=
=
=5×10-11,则PH=-lg
=3.7,
QC=0.022×(5×10-11)2=5.5×10-23<2.2×10-20=Ksp,所以没有Cu2+沉淀.Fe3++3H2O?Fe(OH)3+3H+ 加入这种物质必须促进其水解,而且不能引进新杂质,ABCD都促进水解,水解平衡正向移动,但AD引入新的杂质.
故答案为:3.7;否;BC.
| 1 |
| 2 |
用盖斯定定律进行反应热的计算,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的.通过分析,
目标反应的△H=(4△H1-△H2-△H3)÷2=[-35.6kJ/mol×4-(-890.3kJ/mol)-247.3kJ/mol]÷2=+250.3kJ/mol,故答案为:+250.3kJ/mol.
(2)设起始时n(N2)为xmol,n(H2)为ymol,N2的转化量为amol由方程式可知:
N2 +3H2 ?2NH3
起始量(mol) x y 0
变化量(mol) a 3a 2a
平衡量(mol) x-a 3a 2a
由题意可知:x-a=1.2,y-3a=1.2,2a=0.8,
即:x=1.6mol,y=2.4mol,a=0.4mol,所以反应速率v(N2)=
| ||
| 10min |
H2的转化率为:
| 3×0.4mol |
| 2.4mol |
| (0.4mol/L)2 |
| 0.6mol/L×(0.6mol/L)3 |
其中在保持容器的温度和容积不变,将上述平衡体系中的混合气体均增加0.8mol,相当于给原平衡体系加压,增加压强平衡向正反应方向.
故答案为:0.02mol/(L?min);50%;1.23;平衡向正反应方向;
(3)A.开始阶段反应速率逐渐增大,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,所以该反应是放热反应,故A正确;
B.随着反应的进行,反应物的浓度逐渐减小,所以b点反应物的浓度大于c点,故B错误;
C.根据图象可知c点反应速率还再变化,因此不是平衡状态,故C错误;
D.根据曲线的斜率可知b~c段反应速率快,反应物的转化率大,故D正确.
故答案为:AD;
(4)当Fe3+完全沉淀时,C(OH-)=
| 3 |
| ||
| 3 |
| ||
| 10-14 |
| 5×10-11 |
QC=0.022×(5×10-11)2=5.5×10-23<2.2×10-20=Ksp,所以没有Cu2+沉淀.Fe3++3H2O?Fe(OH)3+3H+ 加入这种物质必须促进其水解,而且不能引进新杂质,ABCD都促进水解,水解平衡正向移动,但AD引入新的杂质.
故答案为:3.7;否;BC.
点评:本题综合性较大,涉及盖斯定律的计算、化学平衡常数、图象分析,平衡移动、盐类水解,难溶电解质的考查等,难度中等,是对学生综合能力的考查,(4)为易错点,判断两者的相对大小是关键.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
常温常压下,某烧碱溶液与0.05mol氯气恰好完全反应,得到pH=9的混合溶液(溶质为NaCl与NaC1O).下列说法正确的是(NA代表阿伏伽德罗常数)( )
| A、氯气的体积为1.12L |
| B、原烧碱溶液中含溶质离子0.2NA |
| C、所得溶液中含OH-的数目为1×10-5NA |
| D、所得溶液中C1O-的数目为0.05NA |
工业是电解饱和食盐水时,下列说法正确的是( )
| A、阳极发生的反应:2H++2e-=H2 |
| B、正极上的反应为:2Cl--2e-=Cl2 |
| C、阳极产生的气体能使湿润的淀粉-KI试纸变蓝 |
| D、电路中通过的电子数为6.02×1023时,共产生气体约11.2L(标准状况) |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
| A、含有 1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| B、脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| C、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D、脱氧过程中铁作原电池正极,电极反应为:Fe-3e-=Fe3+ |
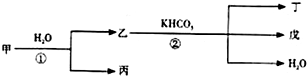 甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.
甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.