题目内容
常温时0.05mol/L的Ba(OH)2溶液,pH为 ( )
A.12.7 B.12.0 C.13.0 D.13.7
练习册系列答案
相关题目
18.形成 1mol H-Cl键时放出431kJ的能量,断裂1molCl-Cl键时吸收243kJ的能量,断裂1mol H-H键时吸收436kJ的能量,则1mol H2(g)与1mol Cl2(g)完全反应生成2mol HCl(g)的能量变化为( )
| A. | 放出248 kJ的热量 | B. | 吸收248 kJ的热量 | ||
| C. | 放出183 kJ的热量 | D. | 吸收183 kJ的热量 |
14.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( )
| A. | K不变,平衡可能移动 | B. | 平衡移动,K值一定变化 | ||
| C. | 平衡移动,K值可能不变 | D. | K值变化,平衡一定移动 |



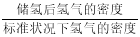 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。