题目内容
7.下列化学用语表示正确的是( )| A. | 次氯酸钙的化学式:CaClO2 | |
| B. | 作为相对原子质量标准的碳原子可表示为:126C | |
| C. | 钠原子的结构示意图: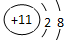 | |
| D. | 硫酸的电离方程式:H2SO4═H++SO42- |
分析 A.次氯酸钙的化学式中含有2个次氯酸根离子;
B.C-12为相对原子质量的标准;
C.钠原子的核电荷数=核外电子总数=11,最外层含有1个电子;
D.硫酸为二元强酸,在溶液中完全电离出2个氢离子和1个硫酸根离子.
解答 解:A.次氯酸钙的化学式中应该含有2个次氯酸根离子,正确的化学式为:Ca(ClO)2,故A错误;
B.作为相对原子质量标准的碳原子含有6个中子,质量数为12,该原子可表示为:126C,故B正确;
C.钠原子的核电荷数、核外电子总数都是11,其正确的原子结构示意图为: ,故C错误;
,故C错误;
D.硫酸为强电解质,其正确的电离方程式为:H2SO4═2H++SO42-,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电离方程式、原子结构示意图、元素符号、化学式等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
18.为了确认电解质溶液中部分离子相互间能否发生反应,及离子反应发生的条件,做如表四组实验.
(1)实验Ⅰ的现象有白色沉淀产生,写出反应的离子方程式Ba++SO42+=BaSO4↓.
(2)实验Ⅱ的目的是验证Cl-与Cu2+不发生反应.
(3)实验Ⅲ的现象证明了溶液中的H+、OH-两种离子之间发生了化学反应.
(4)实验Ⅳ中发生反应的离子方程式是CaCO3+2H+═Ca2++CO2↑+H2O.
| 编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 实验 |  | 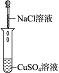 | 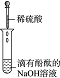 | 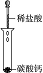 |
(2)实验Ⅱ的目的是验证Cl-与Cu2+不发生反应.
(3)实验Ⅲ的现象证明了溶液中的H+、OH-两种离子之间发生了化学反应.
(4)实验Ⅳ中发生反应的离子方程式是CaCO3+2H+═Ca2++CO2↑+H2O.
16. 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4是N2的同素异形体 | |
| C. | N4分子中N-N键角为109°28′ | |
| D. | 1 mol N4转变成N2将吸收882 kJ热量 |
12.下列叙述正确的是( )
| A. | 碱式碳酸铜、烧碱均属碱 | |
| B. | CO、SO2均属酸性氧化物 | |
| C. | 凡能电离出H+的化合物均属酸 | |
| D. | 盐类物质一定含有金属离子或铵根离子 |
18.形成 1mol H-Cl键时放出431kJ的能量,断裂1molCl-Cl键时吸收243kJ的能量,断裂1mol H-H键时吸收436kJ的能量,则1mol H2(g)与1mol Cl2(g)完全反应生成2mol HCl(g)的能量变化为( )
| A. | 放出248 kJ的热量 | B. | 吸收248 kJ的热量 | ||
| C. | 放出183 kJ的热量 | D. | 吸收183 kJ的热量 |
14.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( )
| A. | K不变,平衡可能移动 | B. | 平衡移动,K值一定变化 | ||
| C. | 平衡移动,K值可能不变 | D. | K值变化,平衡一定移动 |