题目内容
下列有关说法正确的是( )
| A、在多电子的原子里,能量高的电子通常在离核近的区域内运动 |
| B、最外层电子数为8的微粒均是稀有气体元素的原子 |
| C、俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
| D、在周期表中金属和非金属的分界线附近寻找制备半导体材料 |
考点:原子结构与元素的性质,化学史,元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:A.在多电子的原子里,能量高的电子通常在离核远的区域内运动;
B.最外层电子数为8的微粒不一定是稀有气体元素的原子,可能是离子;
C.俄国化学家门捷列夫为元素周期表的建立作出了巨大贡献;
D.在周期表中金属和非金属的分界线附近寻找制备半导体材料,如硅等.
B.最外层电子数为8的微粒不一定是稀有气体元素的原子,可能是离子;
C.俄国化学家门捷列夫为元素周期表的建立作出了巨大贡献;
D.在周期表中金属和非金属的分界线附近寻找制备半导体材料,如硅等.
解答:
解:A.在多电子的原子里,能量高的电子通常在离核远的区域内运动,在离核近的区域内运动的电子是能量低的,故A错误;
B.最外层电子数为8的微粒不一定是稀有气体元素的原子,可能是离子,如钠离子、氧离子等,故B错误;
C.俄国化学家门捷列夫为元素周期表的建立作出了巨大贡献,门捷列夫制作出了第一张元素周期表,故C错误;
D.在周期表中金属和非金属的分界线附近寻找制备半导体材料,如硅等,在过渡元素中寻找催化剂材料,故D正确;
故选D.
B.最外层电子数为8的微粒不一定是稀有气体元素的原子,可能是离子,如钠离子、氧离子等,故B错误;
C.俄国化学家门捷列夫为元素周期表的建立作出了巨大贡献,门捷列夫制作出了第一张元素周期表,故C错误;
D.在周期表中金属和非金属的分界线附近寻找制备半导体材料,如硅等,在过渡元素中寻找催化剂材料,故D正确;
故选D.
点评:本题考查了原子结构、元素周期表的用途、化学史等知识点,知道原子核外电子排布特点、元素周期表的结构及用途即可解答,属于基础题,题目难度不大.

练习册系列答案
相关题目
下列关于氯水的说法中,不正确的是( )
| A、新制氯水具有漂白作用 |
| B、新制氯水呈黄绿色 |
| C、新制氯水应避光保存 |
| D、氯水是指液态的氯 |
在氧化还原反应中,下列叙述正确的是( )
| A、物质失电子的反应为还原反应 |
| B、物质在变化中得到电子,此物质是还原剂 |
| C、发生电子转移的反应即是氧化还原反应 |
| D、发生化合价升降的反应一定是氧化还原反应 |
在水溶液中能量共存的一组离子是( )
| A、Na+、Ba2+、Cl-、NO3- |
| B、Ba2+、Hg2+、S2-、SO42- |
| C、NH4+、H+、SO32-、PO43- |
| D、ClO-、Al3+、Br-、CO32- |
下列对有机物结构或性质的描述,错误的是( )
| A、1-溴丙烷与2-溴丙烷发生消去反应的产物不相同 |
| B、苯、甲苯在一定条件下均能发生取代反应 |
| C、通过红外光谱分析可以区分CH3CH2OH和CH3OCH3 |
D、异戊二烯(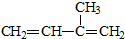 )与等物质的量的溴单质反应,产物只有一种 )与等物质的量的溴单质反应,产物只有一种 |
地球一小时是世界自然基金会应对全球气候变化所提出的一项倡议,以此来激发人们对保护地球的责任感,同时倡导节能减排理念.下列不能达到节能减排目的是( )
| A、利用太阳能分解水获得氢气 |
| B、用家用汽车代替公交车 |
| C、利用化石燃料制造燃料电池 |
| D、在农村推广建造沼气池 |
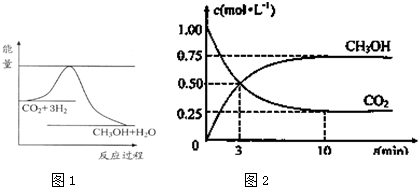
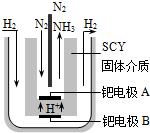 合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.
合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.