题目内容
17.同周期的 IIA 族元素与IIIA族元素核电荷数相差不可能是( )| A. | 1 | B. | 11 | C. | 17 | D. | 25 |
分析 元素周期表中,从第四周期开始出现过渡元素,第ⅠA、ⅡA之后是第ⅢB,在第六、七周期中的过渡元素又出现镧系和锕系,结合周期表的结构及周期中元素种类数来解答.
解答 解:因为是同一周期的IIA族,即同一横行往右一个主族,在第二、三周期原子序数增加1,因而同周期的 IIA 族元素与IIIA族元素核电荷数相差为1;
又因为IIA族与IIIA族元素在第四周期起有过渡元素,因而同周期的IIA 族元素与IIIA族元素核电荷数相差为11;
在第六、七周期的过渡元素中又出现镧系和锕系,因而同周期的 IIA 族元素与IIIA族元素核电荷数相差为25.
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表的结构、元素在周期表的位置为解答的关键,侧重分析与应用能力的考查,注意长周期中结构,题目难度不大.

练习册系列答案
相关题目
5.已知断开1molH-H键吸收的能量为436KJ,形成1molH-H键放出的能量为391KJ,根据化学方程式N2+3H2$?_{高温,高压}^{催化剂}$2NH3,反应完1molN2放出的能量为924KJ,则断开1molN=N键吸收的能量是( )
| A. | 431KJ | B. | 649KJ | C. | 869KJ | D. | 945.6KJ |
12.X、Y是元素周期表ⅦA族中的两种元素.下列叙述中能说明X的原子得电子能力比Y强的是( )
| A. | X原子的电子层数比Y原子电子层数多 | |
| B. | X的氢化物的沸点比Y的氢化物沸点低 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
2.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是:HClO4,碱性最强的化合物的电子式是: .
.
(2)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与⑦的化合物的电子式 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-(要求用离子符号表示).
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为:Cl2+H2O=HClO+H++Cl-.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)用电子式表示元素④与⑥的化合物的形成过程:

(4)表示①与⑦的化合物的电子式
 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-(要求用离子符号表示).
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为:Cl2+H2O=HClO+H++Cl-.
9.下列离子方程式正确的是( )
| A. | NaHS溶液水解的方程式为:HS-+H2O?S2-+H3O+ | |
| B. | 向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| C. | 在100 mL 2 mol/L FeI2溶液中通入4.48 L氯气(标况下),充分反应:2I-+Cl2═I2+2Cl- | |
| D. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ |
6.已知:实验室常用无水乙醇(CH3CH2OH)制备乙烯,制备原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
无水乙醇性质如表:
甲、乙同学用下列实验装置制备乙烯并验证其性质.(气密性已检验,部分夹持装置略).
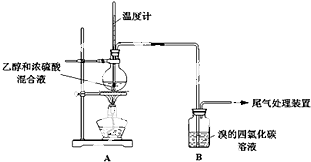
实验操作和现象:
(1)写出乙烯的1个用途:制塑料,对应方程式为(注明反应类型)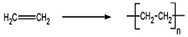 ,加聚反应.
,加聚反应.
(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有脱水性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型)CH2=CH2+Br2→CH2BrCH2Br,加成反应.
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种“有刺激性气味”的气体X.你认为这种“有刺激性气味”气体X是SO2(填化学式).
为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
请回答下列问题:
D中盛放的试剂是NaOH(填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释):5C2H4+4MnO4-+12H+→10CO2↑+4Mn2++16H2O.
无水乙醇性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
| 无水乙醇 | -114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |

实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
 ,加聚反应.
,加聚反应.(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有脱水性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型)CH2=CH2+Br2→CH2BrCH2Br,加成反应.
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种“有刺激性气味”的气体X.你认为这种“有刺激性气味”气体X是SO2(填化学式).
为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
| 设 计 | 现 象 |
与A连接的装置如下: | C中溶液褪色,加热后又恢复红色; F中溶液褪色 |
D中盛放的试剂是NaOH(填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释):5C2H4+4MnO4-+12H+→10CO2↑+4Mn2++16H2O.
 .
.
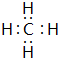 ;
;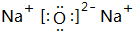 ;
;