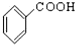
题目内容
12.X、Y是元素周期表ⅦA族中的两种元素.下列叙述中能说明X的原子得电子能力比Y强的是( )| A. | X原子的电子层数比Y原子电子层数多 | |
| B. | X的氢化物的沸点比Y的氢化物沸点低 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
分析 说明X的原子得电子能力比Y强,说明非金属性X>Y,利用单质之间的置换反应、气态氢化物的稳定性、与氢气化合的难易程度等来比较非金属性的强弱,以此来解答.
解答 解:A.X原子的电子层数比Y原子的电子层数多,为同主族元素,则Y的非金属性强,故A不选;
B.X的氢化物的沸点比Y的氢化物的沸点低,不能用来比较非金属性的强弱,故B不选;
C、X的气态氢化物比Y的气态氢化物稳定,则非金属性X>Y,故C选;
D.Y的单质能将X从NaX的溶液中置换出来,则非金属Y>X,故D不选;
故选C.
点评 本题考查非金属的比较,注意归纳常见的非金属比较的方法,明确非金属性与气态氢化物稳定性的关系即可解答,题目难度中等.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案
相关题目
19.在酸性溶液中,下列各组离子可能共存的是( )
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、NO3-、HCO3- | ||
| C. | SO42-、Fe3+、K+、Cl- | D. | NO3-、K+、SO32-、Mg2+ |
20.下列离子方程式错误的是( )
| A. | 向含有3mol的FeI2溶液中通入标准状况下89.6L 氯气:2Fe2++6I-+4Cl2═2Fe3++3I2+8Cl- | |
| B. | 向铜片中滴加18.4mol/L的浓硫酸并加热:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 向氯化银浊液中加入Na2S溶液:2AgCl+S2-═Ag2S+2Cl- | |
| D. | 向NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
7.关于下列各图的叙述正确的是( )

| A. | 甲中△H1=-(△H2+△H3) | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于等物质的量浓度的NaB溶液的pH |
17.同周期的 IIA 族元素与IIIA族元素核电荷数相差不可能是( )
| A. | 1 | B. | 11 | C. | 17 | D. | 25 |
1.下列四种元素中,单质的氧化性最强的是( )
| A. | 原子最外层电子数为次外层电子数的2倍 | |
| B. | 第三周期ШA族元素 | |
| C. | 原子核外L层电子数为K层电子数的3倍 | |
| D. | 第16号元素 |
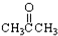 ③CH3CH2Br ④
③CH3CH2Br ④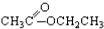 ⑤
⑤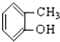 ⑥
⑥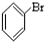 ⑦
⑦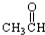 ⑧
⑧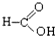 ⑨
⑨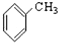 ⑩
⑩