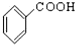
题目内容
9.下列离子方程式正确的是( )| A. | NaHS溶液水解的方程式为:HS-+H2O?S2-+H3O+ | |
| B. | 向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| C. | 在100 mL 2 mol/L FeI2溶液中通入4.48 L氯气(标况下),充分反应:2I-+Cl2═I2+2Cl- | |
| D. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ |
分析 A.水解生成氢硫酸和氢氧根离子;
B.Na2O2作氧化剂、还原剂;
C.n(FeI2)=0.2mol,n(Cl2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,由电子守恒可知只有碘离子被氧化;
D.惰性电极电解饱和氯化钠溶液,生成NaOH、氢气、氯气.
解答 解:A.水解生成氢硫酸和氢氧根离子,则NaHS溶液水解的方程式为HS-+H2O?H2S+OH-,故A错误;
B.Na2O2作氧化剂、还原剂,则向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++2OH-+218OH-+O2↑,故B错误;
C.n(FeI2)=0.2mol,n(Cl2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,由电子守恒可知只有碘离子被氧化,则离子反应为2I-+Cl2═I2+2Cl-,故C正确;
D.惰性电极电解饱和氯化钠溶液,生成NaOH、氢气、氯气,则离子反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重水解、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列离子方程式错误的是( )
| A. | 向含有3mol的FeI2溶液中通入标准状况下89.6L 氯气:2Fe2++6I-+4Cl2═2Fe3++3I2+8Cl- | |
| B. | 向铜片中滴加18.4mol/L的浓硫酸并加热:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 向氯化银浊液中加入Na2S溶液:2AgCl+S2-═Ag2S+2Cl- | |
| D. | 向NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
17.同周期的 IIA 族元素与IIIA族元素核电荷数相差不可能是( )
| A. | 1 | B. | 11 | C. | 17 | D. | 25 |
14.关于下列图象的说法正确的是( )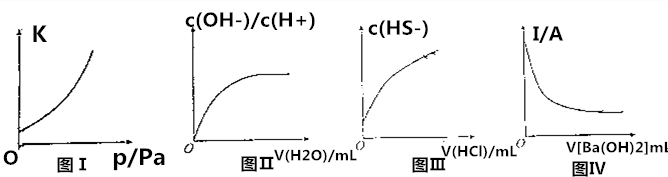

| A. | 图Ⅰ:其他条件不变,反应2NO2(g)?N2O4(g)的平衡常数与压强的关系 | |
| B. | 图Ⅱ:25℃时,稀释0.1mol•L-1CH3COOH溶液,$\frac{c(O{H}^{-})}{c({H}^{+})}$与加水的体积的关系 | |
| C. | 图Ⅲ:25℃时,向0.1mol•L-1Na2S溶液中滴加稀盐酸至足量,c(HS-)与盐酸体积的关系 | |
| D. | 图Ⅳ:一定温度下,稀硫酸的导电能力与加入的Ba(OH)2溶液体积的关系 |
1.下列四种元素中,单质的氧化性最强的是( )
| A. | 原子最外层电子数为次外层电子数的2倍 | |
| B. | 第三周期ШA族元素 | |
| C. | 原子核外L层电子数为K层电子数的3倍 | |
| D. | 第16号元素 |
18.下列说法不正确的是( )
| A. | 催化剂是改变化学反应速率最有效的手段之一,使用催化剂可以带来巨大的经济效益 | |
| B. | 能量是可以互相转化的.植物的光合作用可将太阳能转变成化学能,太阳能电池可将光能转变成电能.原电池和电解池可实现化学能和电能的相互转换 | |
| C. | 有机高分子合成为人类提供了大量的新材料,聚氯乙烯、有机玻璃、腈纶、酚醛树脂等都属于合成高分子材料,都是通过加聚反应得到的 | |
| D. | 计算机技术的发展,使化学研究进入了分子水平,分子设计的思想为合成人类需要的新物质开辟了更广阔的道路 |
19.氧化还原反应在生产、生活中应用广泛.下列反应不属于氧化还原反应的是( )
| A. | 木炭燃烧:C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 | |
| B. | 煅烧石灰石:CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑ | |
| C. | 铁的冶炼:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| D. | 电解水:2H2O$\frac{\underline{\;通电\;}}{\;}$2 H2↑+O2↑ |


 的名称对氟苯甲醛.
的名称对氟苯甲醛. .
. .
.
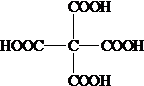 .
.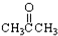 ③CH3CH2Br ④
③CH3CH2Br ④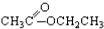 ⑤
⑤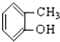 ⑥
⑥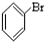 ⑦
⑦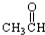 ⑧
⑧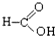 ⑨
⑨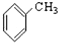 ⑩
⑩