题目内容
2.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)用电子式表示元素④与⑥的化合物的形成过程:

(4)表示①与⑦的化合物的电子式
 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-(要求用离子符号表示).
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为:Cl2+H2O=HClO+H++Cl-.
分析 根据元素在周期表中位置知,①~⑩分别是C、N、O、Na、Al、S、Cl、Ar、K、Br元素,
(1)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;元素的金属性越强,其最高价氧化物的水化物碱性越强,这几种元素中金属性最强的是K,则碱性最强的化合物是KOH,KOH中存在离子键和共价键;
(2)最高价氧化物是两性氧化物的元素是Al;它的氧化物氧化铝与氢氧化钠反应生成偏铝酸钠和水;
(3)④与⑥的化合物是硫化钠,二者通过得失电子生成硫化钠;
(4)①与⑦的化合物是四氯化碳,不同非金属元素之间易形成极性键;
(5)离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(6)元素③的氢化物常温下和元素⑦的单质反应生成HCl、HClO.
解答 解:根据元素在周期表中位置知,①~⑩分别是C、N、O、Na、Al、S、Cl、Ar、K、Br元素,
(1)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,除了O元素外,非金属性最强的是Cl元素,则其最高价氧化物的水化物酸性最强的是HClO4;元素的金属性越强,其最高价氧化物的水化物碱性越强,这几种元素中金属性最强的是K,则碱性最强的化合物是KOH,KOH中存在离子键和共价键,电子式为 ,
,
故答案为:HClO4; ;
;
(2)最高价氧化物是两性氧化物的元素是Al;它的氧化物氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al;Al2O3+2OH-=2AlO2-+H2O;
(3)④与⑥的化合物是硫化钠,二者通过得失电子生成硫化钠,其形成过程为 ,
,
故答案为: ;
;
(4)①与⑦的化合物是四氯化碳,不同非金属元素之间易形成极性键,则四氯化碳中存在极性键,电子式为
故答案为:
(5)离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,离子大小顺序是S2->Cl->O2-,
故答案为:S2->Cl->O2-;
(6)元素③的氢化物常温下和元素⑦的单质反应生成HCl、HClO,离子方程式为Cl2+H2O=HClO+H++Cl-,
故答案为:Cl2+H2O=HClO+H++Cl-.
点评 本题考查元素周期表和元素周期律的综合运用,为高频考点,涉及电子式的书写、离子方程式的书写、元素推断等知识点,明确元素周期表结构、物质结构、物质性质是解本题关键,四氯化碳电子式书写中易漏斗Cl原子上孤电子对,为易错点.

| A. | 原子半径:W>Y>M | |
| B. | 由X、Y、Z、M 四种元素形成的化合物一定既有离子键,又有共价键 | |
| C. | W 和Z 形成的常见化合物中阴、阳离子物质的量之比均为1:2 | |
| D. | 由X 元素形成的单质晶体不一定是原子晶体 |
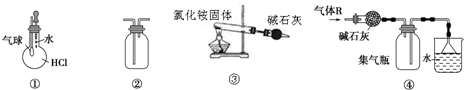
| A. | 装置①可验证HCl气体在水中的溶解性 | |
| B. | 装置②可用排空气法收集H2、NH3、Cl2、HCl、CO2等气体 | |
| C. | 装置③实验室用氯化铵制少量氨气 | |
| D. | 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
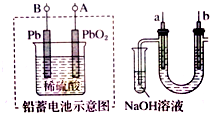
| A. | 铅蓄电池A极应与U形管中a极连接 | |
| B. | 铅蓄电池放电时溶液的pH值变小 | |
| C. | a电极用铁作电极,b电极用石墨作电极 | |
| D. | 实验结束后可将U型管、试管中的溶液倒入下水道 |
| A. | 1 | B. | 11 | C. | 17 | D. | 25 |
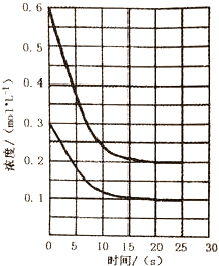
| A. | 从投料到20s时达到平衡,v(A)的反应速率为0.02mol•L-1•s-1 | |
| B. | 若该反应的化学平衡常数K=250,说明D的状态为气态 | |
| C. | 降低温度,有利于加快化学反应速率和提高反应的转化率 | |
| D. | 若D是固体且保持平衡的温度和压强不变,再向容器中充入3mol的B,则此时v正<v逆 |
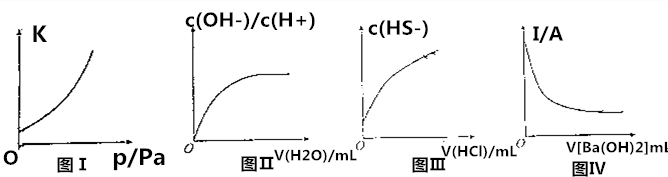
| A. | 图Ⅰ:其他条件不变,反应2NO2(g)?N2O4(g)的平衡常数与压强的关系 | |
| B. | 图Ⅱ:25℃时,稀释0.1mol•L-1CH3COOH溶液,$\frac{c(O{H}^{-})}{c({H}^{+})}$与加水的体积的关系 | |
| C. | 图Ⅲ:25℃时,向0.1mol•L-1Na2S溶液中滴加稀盐酸至足量,c(HS-)与盐酸体积的关系 | |
| D. | 图Ⅳ:一定温度下,稀硫酸的导电能力与加入的Ba(OH)2溶液体积的关系 |
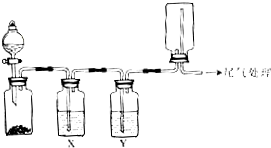 利用下图装置可以进行实验并能达到实验目的是( )
利用下图装置可以进行实验并能达到实验目的是( )| 选项 | 实验目的 | 试剂X | 试剂Y |
| A | Na2SO3和盐酸制取并收集纯净干燥的SO2 | 饱和NaHSO3溶液 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | 苯与浓溴水在铁催化下反应制溴苯并收集HBr | CCl4 | 浓硫酸 |
| D | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
 ;反应类型加聚反应.
;反应类型加聚反应.