题目内容
5.已知断开1molH-H键吸收的能量为436KJ,形成1molH-H键放出的能量为391KJ,根据化学方程式N2+3H2$?_{高温,高压}^{催化剂}$2NH3,反应完1molN2放出的能量为924KJ,则断开1molN=N键吸收的能量是( )| A. | 431KJ | B. | 649KJ | C. | 869KJ | D. | 945.6KJ |
分析 热化学方程式中,反应热=反应物的总键能-生成物的总键能,据此计算出断开1mol N≡N键吸收的能量.
解答 解:已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,设N≡N的键能为x,
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
反应热=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol
解得:x=945.6 kJ/mol,
故选D.
点评 本题考查了反应热的有关计算、反应热与化学键键能的关系,题目难度中等,明确反应热与键能的关系是解答本题的关键.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
13.用下列装置进行的相应实验能达到实验目的是( )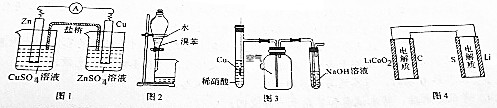

| A. | 图1装置设计铜锌双液原电池 | |
| B. | 图2装置用于分离水和溴苯的混合物 | |
| C. | 图3装置用于制备并收集NO气体 | |
| D. | 图4装置锂硫电池(2Li+S$?_{充电}^{放电}$Li2S)给锂离子电池充电(LixC+Li1-xCo2$?_{充电}^{放电}$C+LiCoO2) |
13.关于下列各装置图的叙述中,正确的是( )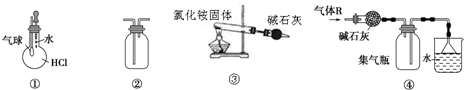

| A. | 装置①可验证HCl气体在水中的溶解性 | |
| B. | 装置②可用排空气法收集H2、NH3、Cl2、HCl、CO2等气体 | |
| C. | 装置③实验室用氯化铵制少量氨气 | |
| D. | 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
20.下列离子方程式错误的是( )
| A. | 向含有3mol的FeI2溶液中通入标准状况下89.6L 氯气:2Fe2++6I-+4Cl2═2Fe3++3I2+8Cl- | |
| B. | 向铜片中滴加18.4mol/L的浓硫酸并加热:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 向氯化银浊液中加入Na2S溶液:2AgCl+S2-═Ag2S+2Cl- | |
| D. | 向NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
10.已知铅蓄电池放电时的反应为PbO2+2H2SO4+Pb═2PbSO4+2H2O.某兴趣小组用铅蓄电池电解饱和食盐水的装置如下图所示,下列说法正确的是( )
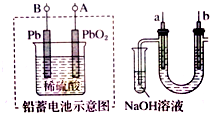

| A. | 铅蓄电池A极应与U形管中a极连接 | |
| B. | 铅蓄电池放电时溶液的pH值变小 | |
| C. | a电极用铁作电极,b电极用石墨作电极 | |
| D. | 实验结束后可将U型管、试管中的溶液倒入下水道 |
17.同周期的 IIA 族元素与IIIA族元素核电荷数相差不可能是( )
| A. | 1 | B. | 11 | C. | 17 | D. | 25 |
14.关于下列图象的说法正确的是( )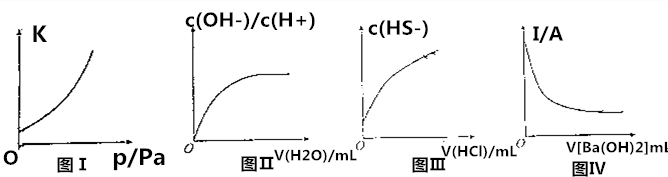

| A. | 图Ⅰ:其他条件不变,反应2NO2(g)?N2O4(g)的平衡常数与压强的关系 | |
| B. | 图Ⅱ:25℃时,稀释0.1mol•L-1CH3COOH溶液,$\frac{c(O{H}^{-})}{c({H}^{+})}$与加水的体积的关系 | |
| C. | 图Ⅲ:25℃时,向0.1mol•L-1Na2S溶液中滴加稀盐酸至足量,c(HS-)与盐酸体积的关系 | |
| D. | 图Ⅳ:一定温度下,稀硫酸的导电能力与加入的Ba(OH)2溶液体积的关系 |
15.已知反应A2+B2═2AB,破坏1mol A2中的化学键消耗的能量为Q1 kJ,破坏1mol B2中的化学键消耗的能量为Q2 kJ,形成1mol AB中的化学键释放的能量为Q3 kJ,则下列说法正确的是( )
| A. | 若A2和B2的总能量大于生成的AB的总能量,则反应放热 | |
| B. | 若A2和B2的总能量小于生成的AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2>Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2>Q3 |