题目内容
20.已知下列两个热化学方程式:2H2(g)+O2(g)→2H2O(l)+571.6kJ,C3H8(g)+5O2(g)→3CO2(g)+4H2O(l)+2220.0kJ.实验测得,H2和C3H8的混合气体共10mol,完全燃烧放热7694kJ,则混合气体中H2和C3H8的体积比是( )| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
分析 先根据方程式求出H2和C3H8的燃烧热,设H2的物质的量为nmol,则C3H8的物质的量为10mol-n,根据放出的热量列方程式解答.
解答 解:设混合气中H2的物质的量为n,则C3H8的物质的量为10mol-n,根据题意,列方程为:
285.8kJ/mol×n+2220.0kJ/mol×(10mol-n)=7694kJ
解得:n=7.5mol,
C3H8的物质的量为10mol-7.5mol=2.5mol,
所以混合气体中H2与C3H8的体积比即物质的量之比为7.5 mol:2.5 mol=3:1,
故选:C.
点评 以常规方法进行计算求解,思路直接,便于理解,但是由于一般需要列方程,步骤烦琐,计算量较大,因此可以选用十字交叉法,比较方便.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
11.根据元素周期律及物质结构的有关知识,判断以下有关排序不正确的是( )
| A. | 原子半径:Al>Mg>Na | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 酸性:HClO4>H2SO4>H2PO4 | D. | 金属性:Na>Mg>Al |
15.有关盐酸与氢氧化钠溶液反应的说法中,错误的是( )
| A. | 属于复分解反应 | B. | 属于放热反应 | ||
| C. | 属于氧化还原反应 | D. | 属于中和反应 |
5.二氧化氮与水反应的方程式中,当有9mol的电子发生转移时,被氧化的物质与被还原的物质的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
12.下列事实与胶体性质有关的是( )
| A. | 用盐卤点豆腐 | B. | 用明矾净水 | ||
| C. | 医药是用三氯化铁止血 | D. | 江河入海中形成的三角洲 |
9.下列属于碱性氧化物的是( )
| A. | Na2O2 | B. | MgO | C. | CaCO3 | D. | NaNO3 |
10.下列关于金属的叙述中正确的是( )
| A. | 所有的金属都是固态的 | |
| B. | 金属具有导电性、导热性和延展性 | |
| C. | 金属都能与酸反应,但不能与碱反应 | |
| D. | 金属元素在自然界中都是以化合态存在的 |
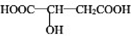 )常用于汽水、糖果的添加剂,
)常用于汽水、糖果的添加剂,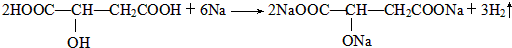 ;
;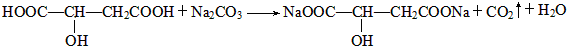
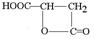 .
.