题目内容
11.根据元素周期律及物质结构的有关知识,判断以下有关排序不正确的是( )| A. | 原子半径:Al>Mg>Na | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 酸性:HClO4>H2SO4>H2PO4 | D. | 金属性:Na>Mg>Al |
分析 A.同周期自左到右,原子半径逐渐减小;
B.元素非金属性越强,气态氢化物越稳定;
C.元素非金属性越强,最高价氧化物对应水化物的酸性越强;
D.同周期自左到右,金属性逐渐减弱.
解答 解:A.同周期自左到右,原子半径逐渐减小,因此原子半径Al<Mg<Na,故A错误;
B.非金属性F>O>N,因此热稳定性HF>H2O>NH3,故B正确;
C.非金属性Cl>S>P,因此酸性HClO4>H2SO4>H3PO4,故C正确;
D.同周期自左到右,金属性逐渐减弱,因此金属性Na>Mg>Al,故D正确;
故选A.
点评 本题考查了元素周期律的知识,难度不大,重点掌握元素非金属性和金属性强弱的判断依据.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
7.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如表所示数据(盐酸的物质的量浓度相等),下列分析推理不正确的是( )
| 盐酸的体积/mL | 50 | 50 | 50 |
| 混合物的质量/g | 9.2 | 15.7 | 27.6 |
| CO2的体积(标准 状况下)/L | 2.24 | 3.36 | 3.36 |
| A. | 盐酸的物质的量浓度为3.0 mol•L-1 | |
| B. | 根据表中数据能计算出混合物中NaHCO3的质量分数为45.65% | |
| C. | 加入混合物9.2 g时盐酸过量 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
2.下列有关化学用语表达正确的是( )
| A. | 氨分子的电子式: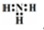 | |
| B. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| C. | O2-的结构示意图为: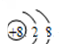 | |
| D. | ${\;}_{35}^{79}$Br的基态原子电子排布式:[Ar]4S24P5 |
19.为提纯下列物质(括号中为杂质),选用的试剂和分离方法都正确的是( )
| 物质 | 除杂试剂 | 分离方法 | |
| A | 碳酸氢钠(碳酸钠) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3 | 洗气 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 氧化铁(氧化铝) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
6.目前,CO、CO2的有效开发利用成为科学家研究的重要课题.
Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ•mol-1、-285.8kJ•mol-1、-764.5kJ•mol-1,则CO(g)+2H2(g)?CH3OH(g)的△H=-90.1kJ•mol-1.
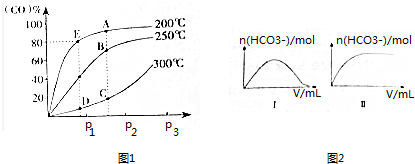
(2)将1molCO和2molH2充入密闭容器中发生上述反应.气体条件相同时,CO的平衡转化率[α(CO)]与压强(p)和温度(T)的关系如图1所示.
①A、B两点CH3OH的质量分数ω(A)>ω(B)(填“>”、“<”或“=”),理由为A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动.
②C、D两点的逆反应速率:v正(C)>v逆(D)(填“>”、“<”或“=”),理由为该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快.
③200℃时,测得E的容器容积为10L.该温度下,反应的平衡常数K=2500;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为0<x<58.
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景.T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,其它条件不变,下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是B(填选项字母).
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g) C.加入催化剂 D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.
已知:25℃时,几种酸的电离平衡常数如下表所示.
25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:①NaHC2O4②HNO3③HClO,溶液中的n(HCO3-)与所加入溶液体积(V)的关系如图2所示.其中,符合曲线Ⅰ的溶液为①②(填序号,下同);符合曲线Ⅱ的溶液为③.

Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ•mol-1、-285.8kJ•mol-1、-764.5kJ•mol-1,则CO(g)+2H2(g)?CH3OH(g)的△H=-90.1kJ•mol-1.
(2)将1molCO和2molH2充入密闭容器中发生上述反应.气体条件相同时,CO的平衡转化率[α(CO)]与压强(p)和温度(T)的关系如图1所示.
①A、B两点CH3OH的质量分数ω(A)>ω(B)(填“>”、“<”或“=”),理由为A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动.
②C、D两点的逆反应速率:v正(C)>v逆(D)(填“>”、“<”或“=”),理由为该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快.
③200℃时,测得E的容器容积为10L.该温度下,反应的平衡常数K=2500;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为0<x<58.
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景.T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,其它条件不变,下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是B(填选项字母).
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g) C.加入催化剂 D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.
已知:25℃时,几种酸的电离平衡常数如下表所示.
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
16.用一种试剂就可以将NaOH、KSCN、AgNO3、Na2SO4四种无色溶液一一鉴别出来,这种试剂是( )
| A. | 稀盐酸 | B. | FeCl3 | C. | Fe(NO3)3 | D. | BaCl2 |
 ,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3;
,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3;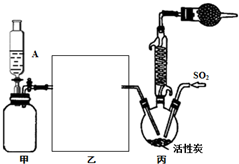 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示: