题目内容
19.已知BF3分子的空间构型为平面三角形,用等电子原理判断,下列分子或离子的立体构型不是平面三角形的是( )| A. | SO3 | B. | PCl3 | C. | NO3- | D. | BCl3 |
分析 根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=配原子个数+孤电子对个数.
解答 解:A.三氧化硫分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(6-3×2)=3,且不含孤电子对,所以为平面三角形结构,故A不选;
B.PCl3分子中,中心P原子成3个σ键、有1对孤对电子,价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4,空间结构为三角锥形,故B选;
C.NO3-中碳原子的价层电子数=3+$\frac{1}{2}$(5+1-3×2)=3,不含孤电子对,空间构型为平面正三角形,故C不选;
D.BCl3分子中,价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3,空间结构为平面正三角形,故D不选;
故选B.
点评 本题考查了微粒空间构型及原子杂化方式,根据价层电子对互斥理论来分析解答即可,难点的孤电子对个数的计算方法,为常考查点,要熟练掌握,题目难度中等.

练习册系列答案
相关题目
9.体积相同、浓度相同的HCl溶液和CH3COOH溶液分别与足量的锌粒(假设锌粒的颗粒大小相同,质量也相同)反应,下列有关说法正确的是( )
| A. | 生成氢气是HCl溶液多 | |
| B. | 生成氢气是CH3COOH溶液多 | |
| C. | 反应速率是HCl溶液与锌反应的快 | |
| D. | 反应速率是CH3COOH溶液与锌反应的快 |
7.关于化合物 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A. | 分子间不能形成氢键 | B. | 分子中既有极性键又有非极性键 | ||
| C. | 分子中有7个σ键和1个π键 | D. | 该分子在水中的溶解度大于2-丁烯 |
4.在CH2=CHCl分子中,C和Cl成键采用的轨道是( )
| A. | p-p | B. | sp-p | C. | sp2-p | D. | sp2-s |
11.下列对有机物结构的叙述中不正确的是( )
| A. | 硝基、羟基、氯原子、苯环、甲基都是官能团 | |
| B. | 邻二甲苯不存在同分异构体,说明苯分子中所有的碳碳键都是完全相同的 | |
| C. | 乙烯、苯分子中所有原子共平面 | |
| D. | CH2Cl2有两种同分异构体 |
8.下列有机反应方程式书写正确且属于取代反应的是( )
| A. | CH2=CH2+Br2→CH2BrCH2Br | B. | 2CH3CH3+Cl2$\stackrel{光照}{→}$2CH3CH2Cl+H2 | ||
| C. | CH3CH2OH+Na→CH3CH2ONa+H2↑ | D. | 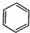 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$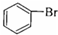 +HBr +HBr |