题目内容
8.相同温度下,体积相同的两个容器中,充入等质量CO2和CO气体,下列判断正确的是( )| A. | CO2和CO对容器产生的压强之比是7:11 | |
| B. | CO2和CO的密度之比是11:7 | |
| C. | CO2和CO的分子数相等 | |
| D. | CO2和CO的氧原子个数比是22:7 |
分析 A.由pV=$\frac{m}{M}$RT可知,M与p成反比;
B.体积相同,质量相同,结合ρ=$\frac{m}{V}$分析;
C.结合n=$\frac{m}{M}$分析;
D.结合n=$\frac{m}{M}$及分子构成计算原子个数比.
解答 解:A.由pV=$\frac{m}{M}$RT可知,M与p成反比,则CO2和CO的压强比为28g/mol:44g/mol=7:11,故A正确;
B.体积相同,质量相同,由ρ=$\frac{m}{V}$可知,密度相同,故B错误;
C.由n=$\frac{m}{M}$可知,CO2和CO的摩尔质量分别为44g/mol、28g/mol,则物质的量不相同,故C错误;
D.质量相同的CO2和CO的物质的量之比为:7:11,氧原子个数比是7×2:11×1=14:11,故D错误;
故选:A.
点评 本题考查阿伏伽德罗定律及应用,为高频考点,把握物质的量计算及阿伏伽德罗定律为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
19.在密闭容器中发生如下反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡时的1.85倍.下列叙述中错误的是( )
| A. | 平衡向逆反应方向移动 | B. | a+b<c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率提高 |
16.下列离子反应方程式,书写正确的是( )
| A. | 向碳酸钠溶液中加醋酸 CO32-+2H+═H2O+CO2↑ | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向盐酸中投入碳酸钙 CO32-+2H+═H2O+CO2↑ | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
3.下列分类或归类正确的是( )
①液氯、氨水、干冰、碘化银均为纯净物
②CaCl2、NaOH、HCl、IBr均为化合物
③明矾、水银、烧碱、硫酸均为电解质
④火碱、纯碱、碳酸钙都是电解质
⑤碘酒、淀粉、水雾、纳米材料均为胶体.
①液氯、氨水、干冰、碘化银均为纯净物
②CaCl2、NaOH、HCl、IBr均为化合物
③明矾、水银、烧碱、硫酸均为电解质
④火碱、纯碱、碳酸钙都是电解质
⑤碘酒、淀粉、水雾、纳米材料均为胶体.
| A. | ①③④ | B. | ②③ | C. | ②④ | D. | ②③④⑤ |
20.对于平衡体系:mA(g)+nB(g)?pC(g)+qD(g),下列判断正确的是( )
| A. | 若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.55 倍,则m+n<p+q | |
| B. | 若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△H<0 | |
| C. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| D. | 若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小 |
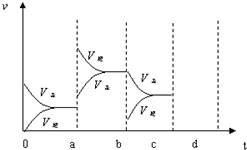 如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).
如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).