题目内容
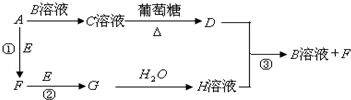
物质A~H有如图所示转化关系(部分生成物未列出).A、E、F、G均为气体,D为金属单质.
请回答下列问题:
(1)A、D、E的化学式分别为 、 、 ,C溶液的名称是 .
(2)反应①的化学方程式为 ;反应③的离子方程式为 .
(3)用惰性电极电解B溶液获得D和E,其中D在 极产生,产生E的电极反应式为 .
(4)高温下,将0.5molG置于2L密闭容器中发生反应:2G?E+2F,平衡后测得E的浓度为0.075mol?L-1,则该温度下上述反应的平衡常数K= (保留两位有效数字);若升高温度,再次达平衡后,测得混合物中含有0.4molF,则反应②的△H 0.(填“>”、“<”或“=”)

请回答下列问题:
(1)A、D、E的化学式分别为
(2)反应①的化学方程式为
(3)用惰性电极电解B溶液获得D和E,其中D在
(4)高温下,将0.5molG置于2L密闭容器中发生反应:2G?E+2F,平衡后测得E的浓度为0.075mol?L-1,则该温度下上述反应的平衡常数K=
考点:无机物的推断,化学平衡的计算,电解原理
专题:推断题,化学平衡专题,电化学专题
分析:C溶液与葡萄糖反应得到金属D,则D为Ag,C为银氨溶液,则气体A为NH3,B为AgNO3,Ag与H溶液反应得到B与气体F,则H为NO3,可推知F为NO、G为NO2,E为O2,据此解答.
解答:
解:C溶液与葡萄糖反应得到金属D,则D为Ag,C为银氨溶液,则气体A为NH3,B为AgNO3,Ag与H溶液反应得到B与气体F,则H为NO3,可推知F为NO、G为NO2,E为O2,
(1)由上述分析可知,A为NH3、D为Ag、E为O2,C溶液的名称是:银氨溶液,
故答案为:NH3;Ag;O2;银氨溶液;
(2)反应①的化学方程式为:4NH3+5O2
4NO+6H2O;反应③的离子方程式为:3Ag+4H++NO3-=3Ag++2H2O+NO↑,
故答案为:4NH3+5O2
4NO+6H2O;3Ag+4H++NO3-=3Ag++2H2O+NO↑;
(3)用惰性电极电解AgNO3溶液获得Ag和O2,银离子发生还原反应,Ag在阴极产生,产生氧气的电极反应式为:4OH--4e-=O2↑+2H2O,
故答案为:阴;4OH--4e-=O2↑+2H2O;
(4)高温下,将0.5molNO2置于2L密闭容器中发生反应:2NO2?O2+2NO,平衡后测得O2的浓度为0.075mol?L-1,
2 NO2?O2+2 NO
开始(mol/L):0.25 0 0
变化(mol/L):0.15 0.075 0.15
平衡(mol/L):0.1 0.075 0.15
故平衡常数k=
=0.17
平衡时NO为0.15mol/L×2=0.3mol,若升高温度,再次达平衡后,测得混合物中含有0.4molNO,大于0.3mol,说明反应2NO2?O2+2NO的平衡向正反应方向移动,正反应为吸热反应,故则反应②为放热反应,即△H<0,
故答案为:0.17;<.
(1)由上述分析可知,A为NH3、D为Ag、E为O2,C溶液的名称是:银氨溶液,
故答案为:NH3;Ag;O2;银氨溶液;
(2)反应①的化学方程式为:4NH3+5O2
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(3)用惰性电极电解AgNO3溶液获得Ag和O2,银离子发生还原反应,Ag在阴极产生,产生氧气的电极反应式为:4OH--4e-=O2↑+2H2O,
故答案为:阴;4OH--4e-=O2↑+2H2O;
(4)高温下,将0.5molNO2置于2L密闭容器中发生反应:2NO2?O2+2NO,平衡后测得O2的浓度为0.075mol?L-1,
2 NO2?O2+2 NO
开始(mol/L):0.25 0 0
变化(mol/L):0.15 0.075 0.15
平衡(mol/L):0.1 0.075 0.15
故平衡常数k=
| 0.075×0.152 |
| 0.12 |
平衡时NO为0.15mol/L×2=0.3mol,若升高温度,再次达平衡后,测得混合物中含有0.4molNO,大于0.3mol,说明反应2NO2?O2+2NO的平衡向正反应方向移动,正反应为吸热反应,故则反应②为放热反应,即△H<0,
故答案为:0.17;<.
点评:本题比较综合,涉及无机物推断、电解原理、化学平衡常数计算及影响因素等,难度中等,“C溶液与葡萄糖反应生成金属”是推断突破口,需要学生具备扎实的基础.

练习册系列答案
相关题目
要除去FeCl3溶液中的FeCl2杂质,采用的方法是( )
| A、加入足量的镁粉 |
| B、通入Cl2气 |
| C、加入足量的铜粉 |
| D、加入足量的Fe粉 |
需要垫上石棉网加热的仪器是( )
| A、试管 | B、圆底烧瓶 |
| C、坩埚 | D、蒸发皿 |
某金属能与盐酸反应产生氢气,该金属与锌组成的原电池中,锌为负极.该金属为( )
| A、铝 | B、铜 | C、铁 | D、镁 |
在相同温度下,下列两个反应放出的热量分别用Q1和Q2表示:则下列关系正确的是( )H2(g)+
O2(g)=H2O(g)△H=-Q1kJ/mol2H2(g)+O2(g)=2H2O(l)△H=-Q2kJ/mol.
| 1 |
| 2 |
| A、Q1=Q2 | ||
B、
| ||
C、Q1<
| ||
D、Q1=
|
NA为阿伏加德罗常数,下列物质中所含分子数最少的是( )
| A、标准状况下4.48L的一氧化碳 |
| B、0.1 mol的氮气 |
| C、0.4g的氢气(H2的摩尔质量为2g?mol-1 |
| D、含0.5NA个分子的氯气 |