题目内容
要除去FeCl3溶液中的FeCl2杂质,采用的方法是( )
| A、加入足量的镁粉 |
| B、通入Cl2气 |
| C、加入足量的铜粉 |
| D、加入足量的Fe粉 |
考点:物质的分离、提纯的基本方法选择与应用,铁盐和亚铁盐的相互转变,物质的分离、提纯和除杂
专题:几种重要的金属及其化合物
分析:氯化亚铁能与氯气反应生成氯化铁,且不引入新的杂质,以此来解答.
解答:
解:A.Mg与氯化铁、氯化亚铁均反应,不能除杂,故A不选;
B.通入Cl2,发生的离子反应为2Fe2++Cl2=2Fe3++2Cl-,不引入新杂质,故B选;
C.Cu与氯化铁反应,将原物质除去,故C不选;
D.Fe与氯化铁反应,将原物质除去,故D不选;
故选B.
B.通入Cl2,发生的离子反应为2Fe2++Cl2=2Fe3++2Cl-,不引入新杂质,故B选;
C.Cu与氯化铁反应,将原物质除去,故C不选;
D.Fe与氯化铁反应,将原物质除去,故D不选;
故选B.
点评:本题考查物质的分离、提纯方法及选择,为高频考点,把握物质的性质及除杂的原则为解答的关键,注意发生的氧化还原反应,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在NaIO3的碱性溶液中通入Cl2,可用得到Na2H3IO6.对于该反应的说法正确的是( )
| A、每生成1mol Na2H3IO6转移2mol电子 |
| B、碱性条件下,NaIO3的氧化性强于Na2H3IO6 |
| C、该反应中Cl2做还原剂 |
| D、氧化产物与还原产物的物质的量之比为2:1 |
向10mL 0.1mol/L Na2CO3溶液中逐滴滴加V mL 0.1mol/L HCl溶液,下列有关滴定过程中粒子浓度关系正确的是( )
| A、当V=0时,[OH-]=[H+]+[HCO3-]+2[H2CO3] |
| B、当V=5时,[Na+]+[H+]=2[CO32-]+[HCO3-]+[OH-] |
| C、当V=10时,[Cl-]=[CO32-]+[HCO3-]+[H2CO3] |
| D、当V=15时,[Na+]=[Cl-]>[HCO3-]>[OH-]>[H+] |
你不慎将一杯水倒入家中的菜油中,最好采用下列何种方法分离( )
| A、过滤 | B、分液 | C、蒸馏 | D、萃取 |
某气体通入品红溶液,溶液褪色,加热后恢复红色,则该气体是( )
| A、N2 |
| B、SO2 |
| C、O2 |
| D、H2 |
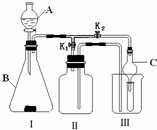 某研究性学习小组设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.
某研究性学习小组设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.