题目内容
(1)实验室用钠和硫酸铜溶液反应,有关反应的化学方程式有: , ;
(2)表面附有氧化膜(成分是MgO)的镁条放入稀硫酸中,开始反应时的离子方程式是: ;
反应片刻后,可观察到有气体产生,其离子方程式是: .
(3)用小苏打片(NaHCO3)治疗胃酸(0.2%~0.4%的盐酸)过多的化学方程式为: .
(4)看图回答下列问题:
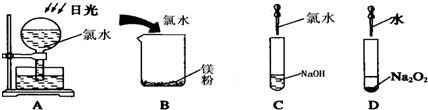
图中不会产生气体的是 (填编号),写出D中发生反应的化学方程式: .
(2)表面附有氧化膜(成分是MgO)的镁条放入稀硫酸中,开始反应时的离子方程式是:
反应片刻后,可观察到有气体产生,其离子方程式是:
(3)用小苏打片(NaHCO3)治疗胃酸(0.2%~0.4%的盐酸)过多的化学方程式为:
(4)看图回答下列问题:

图中不会产生气体的是
考点:钠的化学性质,化学方程式的书写,钠的重要化合物,镁、铝的重要化合物
专题:几种重要的金属及其化合物
分析:(1)钠先和水反应生成NaOH和氢气,NaOH再和硫酸铜发生复分解反应;
(2)Mg表面的氧化物薄膜为MgO,MgO先和稀盐酸反应生成氯化镁和水,然后Mg再和HCl反应生成氯化镁和氢气;
(3)碳酸氢钠和稀盐酸反应生成氯化钠、二氧化碳和水;
(4)A.氯气和水反应生成HCl和HClO,HClO光照分解生成HCl和氧气;
B.盐酸和Mg反应生成氯化镁和氢气;
C.氯气、HCl、HClO与NaOH反应没有气体生成;
D.水和过氧化钠反应生成NaOH和氧气.
(2)Mg表面的氧化物薄膜为MgO,MgO先和稀盐酸反应生成氯化镁和水,然后Mg再和HCl反应生成氯化镁和氢气;
(3)碳酸氢钠和稀盐酸反应生成氯化钠、二氧化碳和水;
(4)A.氯气和水反应生成HCl和HClO,HClO光照分解生成HCl和氧气;
B.盐酸和Mg反应生成氯化镁和氢气;
C.氯气、HCl、HClO与NaOH反应没有气体生成;
D.水和过氧化钠反应生成NaOH和氧气.
解答:
解:(1)钠先和水反应生成NaOH和氢气,反应方程式为2Na+2H2O=2 NaOH+H2↑,NaOH再和硫酸铜发生复分解反应,反应方程式为2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,故答案为:2Na+2H2O=2 NaOH+H2↑;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(2)Mg表面的氧化物薄膜为MgO,MgO先和稀盐酸反应生成氯化镁和水,离子反应方程式为MgO+2H+=Mg2++H2O,然后Mg再和HCl反应生成氯化镁和氢气,离子反应方程式为Mg+2H+=Mg2++H2↑,
故答案为:MgO+2H+=Mg2++H2O;Mg+2H+=Mg2++H2↑;
(3)碳酸氢钠和稀盐酸反应生成氯化钠、二氧化碳和水,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,故答案为:NaHCO3+HCl=NaCl+CO2↑+H2O;
(4)A.氯气和水反应生成HCl和HClO,HClO光照分解生成HCl和氧气,反应方程式为Cl2+H2O=HCl+HClO、2HClO=2HCl+O2↑,所以有气体生成,故A错误;
B.盐酸和Mg反应生成氯化镁和氢气,离子方程式为Mg+2H+=Mg2++H2↑,所以有气体生成,故B错误;
C.氯气、HCl、HClO与NaOH反应没有气体生成,反应方程式为2NaOH+Cl2=NaCl+NaClO+H2O、HCl+NaOH=NaCl+H2O、NaOH+HClO=NaClO+H2O,所以没有气体生成,故C正确;
D.水和过氧化钠反应生成NaOH和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,所以有气体生成,故D错误;
所以没有气体生成的是C,D中的反应为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:C;2Na2O2+2H2O=4NaOH+O2↑.
(2)Mg表面的氧化物薄膜为MgO,MgO先和稀盐酸反应生成氯化镁和水,离子反应方程式为MgO+2H+=Mg2++H2O,然后Mg再和HCl反应生成氯化镁和氢气,离子反应方程式为Mg+2H+=Mg2++H2↑,
故答案为:MgO+2H+=Mg2++H2O;Mg+2H+=Mg2++H2↑;
(3)碳酸氢钠和稀盐酸反应生成氯化钠、二氧化碳和水,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,故答案为:NaHCO3+HCl=NaCl+CO2↑+H2O;
(4)A.氯气和水反应生成HCl和HClO,HClO光照分解生成HCl和氧气,反应方程式为Cl2+H2O=HCl+HClO、2HClO=2HCl+O2↑,所以有气体生成,故A错误;
B.盐酸和Mg反应生成氯化镁和氢气,离子方程式为Mg+2H+=Mg2++H2↑,所以有气体生成,故B错误;
C.氯气、HCl、HClO与NaOH反应没有气体生成,反应方程式为2NaOH+Cl2=NaCl+NaClO+H2O、HCl+NaOH=NaCl+H2O、NaOH+HClO=NaClO+H2O,所以没有气体生成,故C正确;
D.水和过氧化钠反应生成NaOH和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,所以有气体生成,故D错误;
所以没有气体生成的是C,D中的反应为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:C;2Na2O2+2H2O=4NaOH+O2↑.
点评:本题考查物质之间的反应,明确物质性质是解本题关键,钠投入任何电解质水溶液中时先和水反应,然后生成的NaOH可能和电解质反应,题目难度不大.

练习册系列答案
相关题目
向10mL 0.1mol/L Na2CO3溶液中逐滴滴加V mL 0.1mol/L HCl溶液,下列有关滴定过程中粒子浓度关系正确的是( )
| A、当V=0时,[OH-]=[H+]+[HCO3-]+2[H2CO3] |
| B、当V=5时,[Na+]+[H+]=2[CO32-]+[HCO3-]+[OH-] |
| C、当V=10时,[Cl-]=[CO32-]+[HCO3-]+[H2CO3] |
| D、当V=15时,[Na+]=[Cl-]>[HCO3-]>[OH-]>[H+] |
某饮用水的理化指标:钙≥4.0mg/L、钾≥0.35mg/L、钠≥0.8mg/L、镁≥0.5mg/L,以上钙、钾、钠、镁指的是( )
| A、分子 | B、氧化物 | C、元素 | D、单质 |
三聚氰胺的结构简式如图,下列说法不正确的是( )


| A、三聚氰胺分子式C3N6H6,相对分子质量126 |
| B、已知合成三聚氰胺的反应是:6(NH2)CO→C3N6H6+6NH3+3CO2,反应物是尿素 |
| C、三聚氰胺分子所有原子在一个平面上 |
| D、三聚氰胺呈弱碱性,与盐酸、硫酸、硝酸、乙酸、草酸等都能形成三聚氰胺盐 |
某气体通入品红溶液,溶液褪色,加热后恢复红色,则该气体是( )
| A、N2 |
| B、SO2 |
| C、O2 |
| D、H2 |
下列有关金属腐蚀与防护的说法正确的是( )
| A、在酸性环境下,钢铁只能发生析氢腐蚀 |
| B、金属腐蚀的实质是金属失去电子被还原的过程 |
| C、轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法 |
| D、铜铁交接处,在潮湿的空气中直接发生反应:Fe-3e-═Fe3+,继而形成铁锈 |
离子化合物一般比共价化合物硬度高,密度大,难于压缩,难于挥发,有较高的熔沸点.则下列化合物中沸点最高的是( )
| A、HCl |
| B、H2O |
| C、NaCl |
| D、CO2 |
 甲、乙、丙三种物质的溶解度曲线如右图所示.据图回答:
甲、乙、丙三种物质的溶解度曲线如右图所示.据图回答: