题目内容
在25℃,101kPa条件下,将20L O2通入10L CO和CH4的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
(1)若剩余气体的体积是17.5L,则原CO和H2的混合气中V(CO)= L,V(CH4)= L.
(2)若剩余气体的体积为a L,则原CO和H2的混合气中V(CO):V(CH4)= .
(3)若剩余气体的体积为aL,则a的取值范围是 .
(1)若剩余气体的体积是17.5L,则原CO和H2的混合气中V(CO)=
(2)若剩余气体的体积为a L,则原CO和H2的混合气中V(CO):V(CH4)=
(3)若剩余气体的体积为aL,则a的取值范围是
考点:有关混合物反应的计算
专题:计算题
分析:(1)设CO气体的xL,则甲烷为(10-x)L,利用方程式根据差量法表示出体积变化量,再根据剩余的气体的体积列方程计算混合物中气体的体积;
(2)根据(1)中的关系式计算CO、甲烷的体积;
(3)由(1)中的关系式计算a的表达式,结合0<x<10计算.
(2)根据(1)中的关系式计算CO、甲烷的体积;
(3)由(1)中的关系式计算a的表达式,结合0<x<10计算.
解答:
解:(1)设V(CO)为xL,则V(CH4)为(10-x)L
2CO+O2
2CO2 △V
2 1 2 1
xL 0.5xL
CH4+2O2
CO2+2H2O△V
1 2 2
(10-x)L 2(10-x)L
则0.5x+2(10-x)=20+10-17.5,解得x=5,
即V(CO)=5L,则V(H2)=(10-x)L=10L-5L=5L,
故答案为:5;5;
(2)由(1)可得:0.5x+2(10-x)=20+10-a,
解得x=
(a-10),V(CH4)=(10-x)L=
(25-a)L,
即 V(CO):V(CH4)=(a-10):(25-a)
故答案为:(a-10):(25-a);
(3)由(1)可得:0.5x+2(10-x)=20+10-a,
解得a=1.5x+10
因0<x<10,则10<a<25,
故答案为:10<a<25.
2CO+O2
| ||
2 1 2 1
xL 0.5xL
CH4+2O2
| ||
1 2 2
(10-x)L 2(10-x)L
则0.5x+2(10-x)=20+10-17.5,解得x=5,
即V(CO)=5L,则V(H2)=(10-x)L=10L-5L=5L,
故答案为:5;5;
(2)由(1)可得:0.5x+2(10-x)=20+10-a,
解得x=
| 2 |
| 3 |
| 2 |
| 3 |
即 V(CO):V(CH4)=(a-10):(25-a)
故答案为:(a-10):(25-a);
(3)由(1)可得:0.5x+2(10-x)=20+10-a,
解得a=1.5x+10
因0<x<10,则10<a<25,
故答案为:10<a<25.
点评:本题混合物的有关计算,难度中等,明确反应前后体积的变化及该条件下水的状态是关键,注意差量法的利用.

练习册系列答案
相关题目
下列确定某溶液中一定有SO
的方法中,正确的是( )
2- 4 |
| A、先加BaCl2溶液有白色沉淀,再加稀盐酸沉淀不消失 |
| B、先加BaCl2溶液有白色沉淀,再加稀硝酸沉淀不消失 |
| C、先加Ba(NO3)2溶液有白色沉淀,再加稀盐酸沉淀不消失 |
| D、先加稀盐酸无明显现象,再加BaCl2溶液有白色沉淀 |
将镁粉和碳酸镁的混和物置于氧气中灼烧,直至质量不再改变为止,经测定,灼烧后所得的固体质量与原混和物的质量相同,则原混和物中镁粉和碳酸镁的质量比为( )
| A、4:7 | B、10:7 |
| C、14:11 | D、11:14 |
在NaIO3的碱性溶液中通入Cl2,可用得到Na2H3IO6.对于该反应的说法正确的是( )
| A、每生成1mol Na2H3IO6转移2mol电子 |
| B、碱性条件下,NaIO3的氧化性强于Na2H3IO6 |
| C、该反应中Cl2做还原剂 |
| D、氧化产物与还原产物的物质的量之比为2:1 |
向10mL 0.1mol/L Na2CO3溶液中逐滴滴加V mL 0.1mol/L HCl溶液,下列有关滴定过程中粒子浓度关系正确的是( )
| A、当V=0时,[OH-]=[H+]+[HCO3-]+2[H2CO3] |
| B、当V=5时,[Na+]+[H+]=2[CO32-]+[HCO3-]+[OH-] |
| C、当V=10时,[Cl-]=[CO32-]+[HCO3-]+[H2CO3] |
| D、当V=15时,[Na+]=[Cl-]>[HCO3-]>[OH-]>[H+] |
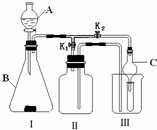 某研究性学习小组设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.
某研究性学习小组设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.