题目内容
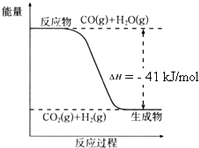 (1)根据如图写出热化学方程式:
(1)根据如图写出热化学方程式:(2)若反应中释放了61.5kJ的热量,则该反应中生成的H2为
(3)已知 2H2(g)+O2(g)=2H2O (g)△H=-484kJ/mol,
结合 如图写出CO(g)完全燃烧生成CO2(g)的热化学方程式:
考点:反应热和焓变,热化学方程式
专题:化学反应中的能量变化
分析:(1)图象分析反应物能量高于生成物且是蒸发进行的反应,标注物质聚集状态和对应反应的焓变写出热化学方程式;
(2)依据热化学方程式计算得到生成氢气物质的量;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
(2)依据热化学方程式计算得到生成氢气物质的量;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
解答:
解:(1)图象分析可知为放热反应,反应的热化学方程式为:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41 kJ/mol,
故答案为:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41 kJ/mol;
(2)依据热化学方程式计算,若反应中释放了61.5kJ的热量,则
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41 kJ/mol;
1mol 41KJ
n(H2) 61.5KJ
n(H2)=1.5mol,
故答案为:1.5;
(3)①2H2(g)+O2(g)=2H2O (g)△H=-484kJ/mol,
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41 kJ/mol
依据盖斯定律②×2+①得到:2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol,
图中是1mol一氧化碳燃烧反应,热化学方程式为:CO(g)+
O2(g)=CO2(g)△H=-283 kJ/mol,
故答案为:CO(g)+
O2(g)=CO2(g)△H=-283 kJ/mol.
故答案为:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41 kJ/mol;
(2)依据热化学方程式计算,若反应中释放了61.5kJ的热量,则
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41 kJ/mol;
1mol 41KJ
n(H2) 61.5KJ
n(H2)=1.5mol,
故答案为:1.5;
(3)①2H2(g)+O2(g)=2H2O (g)△H=-484kJ/mol,
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41 kJ/mol
依据盖斯定律②×2+①得到:2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol,
图中是1mol一氧化碳燃烧反应,热化学方程式为:CO(g)+
| 1 |
| 2 |
故答案为:CO(g)+
| 1 |
| 2 |
点评:本题考查了化学反应能量变化分析,图象判断,热化学方程式书写和盖斯定律的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列状态的物质,既能导电又属于电解质的是( )
| A、KCl溶液 |
| B、液态HCl |
| C、熔融的NaOH |
| D、蔗糖溶液 |
通过一个阶段的复习,你认为下列说法正确的是( )
| A、在氧化还原反应中,一种元素被氧化的同时一定有另一种元素被还原 |
| B、在101KPa下,1mol物质完全燃烧的反应热叫做该物质的热值 |
| C、在化合物中,不是电解质就是非电解质 |
| D、对于可逆反应,温度升高则该反应的平衡常数一定增大 |

 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签