题目内容
下列状态的物质,既能导电又属于电解质的是( )
| A、KCl溶液 |
| B、液态HCl |
| C、熔融的NaOH |
| D、蔗糖溶液 |
考点:电解质与非电解质
专题:电离平衡与溶液的pH专题
分析:在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液中和熔融状态下都不导电的化合物;能导电的物质中含有自由电子或离子,据此分析解答.
解答:
解:A.KCl溶液能导电,但是混合物,不是电解质,故A不符合;
B.液态氯化氢是电解质,但不能导电,故B不符合;
C.NaOH固体是电解质,熔融时电离出自由移动的离子,能导电,故C符合;
D.蔗糖属于非电解质,溶液不导电,故D不符合;
故选:C.
B.液态氯化氢是电解质,但不能导电,故B不符合;
C.NaOH固体是电解质,熔融时电离出自由移动的离子,能导电,故C符合;
D.蔗糖属于非电解质,溶液不导电,故D不符合;
故选:C.
点评:本题考查了电解质、非电解质概念的分析判断,物质组成和概念理解是解题关键,题目较简单.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
下列实验能达到预期目的是( )
| A、为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后再加硝酸钡溶液 |
| B、向混有碳酸钾的氯化钾溶液中加入适量的盐酸,除去其中的碳酸钾 |
| C、向煮沸的1mol?L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| D、利用丁达尔效应可区别Na2CO3溶液与Al(OH)3胶体 |
下列有关项目的比较中,错误的是( )
| A、酸性:H2SO4>HClO4 |
| B、氧化性:Fe3+>Fe2+ |
| C、稳定性:HF>HCl |
| D、原子半径:Na>Mg |
第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子.下列关于天然气水合物中两种分子极性的描述正确的是( )
| A、两种都是极性分子 |
| B、两种都是非极性分子 |
| C、CH4是极性分子,H2O是非极性分子 |
| D、H2O是极性分子,CH4是非极性分子 |
两种元素原子X和Y,Y原子的第三层比氩原子的第三层少6个电子,Y原子的第二层电子数恰为X原子第二层电子数的2倍,则X、Y的质子数分别为( )
| A、14和12 | B、6和12 |
| C、12和6 | D、8和12 |
下列关于CO和N2的判断错误的是( )
| A、体积相等时质量一定相等 |
| B、电子数相等时具有相等的原子数 |
| C、同温同压下质子数相等则体积相等 |
| D、质量相等时具有相等的分子数 |
某温度下在密闭容器中发生如下反应:2SO2+O2?2SO3(g),若开始时只充入2mol SO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2mol SO2和1mol O2的混合气体,达到平衡时SO2的转化率为( )
| A、20% | B、40% |
| C、50% | D、60% |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,11.2L氮气所含的原子数目为NA |
| B、NA个甲烷分子和1mol甲烷的质量相等 |
| C、2L 1mol?L-1的盐酸中所含氯化氢分子数约为2NA |
| D、常温下,0.05mol CO和SO2混合气体中所含氧原子数为0.1NA |
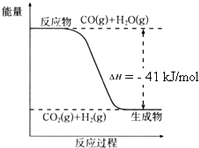 (1)根据如图写出热化学方程式:
(1)根据如图写出热化学方程式: