题目内容
通过一个阶段的复习,你认为下列说法正确的是( )
| A、在氧化还原反应中,一种元素被氧化的同时一定有另一种元素被还原 |
| B、在101KPa下,1mol物质完全燃烧的反应热叫做该物质的热值 |
| C、在化合物中,不是电解质就是非电解质 |
| D、对于可逆反应,温度升高则该反应的平衡常数一定增大 |
考点:电解质与非电解质,氧化还原反应,燃烧热,化学平衡常数的含义
专题:物质的分类专题,氧化还原反应专题
分析:A.氧化还原反应中,可以是同种元素之间发生反应;
B.25℃、101kPa时,热值指在一定条件下每克物质完全燃烧生成稳定的氧化物所放出的热量;
C.化合物可分为电解质和非电解质;
D.对于可逆反应,升高温度,平衡不一定向正反应方向移动.
B.25℃、101kPa时,热值指在一定条件下每克物质完全燃烧生成稳定的氧化物所放出的热量;
C.化合物可分为电解质和非电解质;
D.对于可逆反应,升高温度,平衡不一定向正反应方向移动.
解答:
解:A.氧化还原反应中,可以是同种元素之间发生反应,如氯气和水的反应,氯气自身发生氧化还原反应,故A错误;
B.在101KPa下,一定条件下每克物质完全燃烧生成稳定的氧化物所放出的热量叫做该物质的热值,故B错误;
C.化合物可分为电解质和非电解质,故C正确;
D.对于可逆反应,升高温度,平衡向正反应方向移动,则平衡常数增大,向逆反应方向移动,在平衡常数减小,故D错误.
故选C.
B.在101KPa下,一定条件下每克物质完全燃烧生成稳定的氧化物所放出的热量叫做该物质的热值,故B错误;
C.化合物可分为电解质和非电解质,故C正确;
D.对于可逆反应,升高温度,平衡向正反应方向移动,则平衡常数增大,向逆反应方向移动,在平衡常数减小,故D错误.
故选C.
点评:本题考查较为综合,涉及氧化还原反应、原电池、电解质与非电解质以及平衡移动问题,全面考查化学知识的综合应用,题目较为基础.

练习册系列答案
相关题目
下列变化需要加入还原剂才能实现的反应是( )
| A、F--→HF |
| B、HCl-→Cl2 |
| C、CO32--→CO2↑ |
| D、ClO3--→Cl2 |
若1gN2中含有x个分子,则阿伏加德罗常数是( )
A、
| ||
B、
| ||
| C、14x mol-1 | ||
| D、28x mol-1 |
硫酸铅广泛应用于制造蓄电池、白色颜料等.利用锌冶炼过程中的铅浮渣(铅浮渣的主要成分是PbO、Pb还含有少量的Ag、Zn、CaO和其他不溶于硝酸的杂质)生产硫酸铅的流程如下:
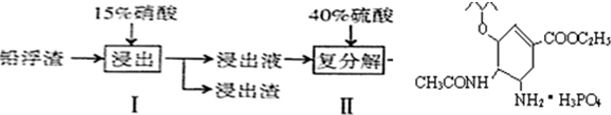
下表是25°C时某些盐的浓度积常数,
下列说法不正确的是( )

下表是25°C时某些盐的浓度积常数,
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
| A、步骤I有NO产生,浸出液中含量最多的金属阳离子为Pb2+ |
| B、步骤I需控制硝酸的用量并使Pb稍有剩余,其目的是防止Ag被溶解进入溶液 |
| C、母液可循环利用于步骤I,其溶质主要是Pb(NO3)2 |
| D、产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去CaSO4 |
下列气体在同温度、同体积、同质量时,压强最大的是( )
| A、CO2 |
| B、CO |
| C、CH4 |
| D、H2 |
在标准状况下,11g二氧化碳的体积约为( )
| A、28L | B、11.2L |
| C、16.8L | D、5.6L |
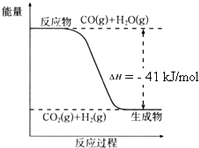 (1)根据如图写出热化学方程式:
(1)根据如图写出热化学方程式: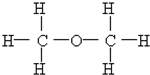 ⑩
⑩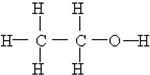 (11)
(11)
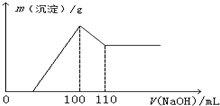 某学生课外兴趣小组为研究某镁铝合金的成分,用天平称取0.51g该合金,溶于100mL盐酸,形成无色溶液,然后逐滴加入1mol?L-1 NaOH溶液,生成沉淀质量随NaOH溶液体积变化如图所示.求:
某学生课外兴趣小组为研究某镁铝合金的成分,用天平称取0.51g该合金,溶于100mL盐酸,形成无色溶液,然后逐滴加入1mol?L-1 NaOH溶液,生成沉淀质量随NaOH溶液体积变化如图所示.求: