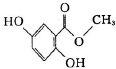
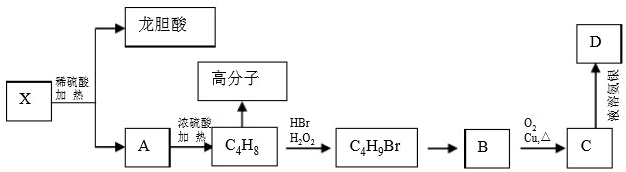
题目内容
Na2CO3、NaHCO3、NaCl的固体混合物共40g,把它们加强热到质量不再减轻,冷却后称重为33.8g.在残余固体中加入过量的盐酸,产生CO2在标准状态下体积为4.48L.
请回答:
(1)求原混合物中NaHCO3的质量?
(2)求原混合物中Na2CO3的质量分数?
请回答:
(1)求原混合物中NaHCO3的质量?
(2)求原混合物中Na2CO3的质量分数?
考点:有关混合物反应的计算,钠的重要化合物
专题:计算题
分析:加热发生反应:2NaHCO3
Na2CO3+CO2↑+H2O,导致固体质量减少,利用差量法计算原混合物中NaHCO3的质量、生成碳酸钠的质量,根据CO2在标准状态下体积可计算加热后总的Na2CO3的质量,减去NaHCO3分解生成的Na2CO3的质量即可得原混合物中Na2CO3的质量,进而计算原混合物中碳酸钠的质量分数.
| ||
解答:
解:设混合物中有NaHCO3的质量为x,生成Na2CO3的质量为y,
2NaHCO3=Na2CO3+CO2↑+H2O△m
168g 106g 62g
x y 40g-33.8g=6.2g
x=
=16.8g,
生成的质量为m(Na2CO3)=
=10.6g,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106g 22.4L
m 4.48L
m=
=21.2g
故原混合物中碳酸钠的质量=21.2g-10.6g=10.6g,
所以原混合物中Na2CO3的质量分数为:
=26.5%,
答:(1)原混合物中NaHCO3的质量为16.8;
(2)原混合物中Na2CO3的质量分数为26.5%.
2NaHCO3=Na2CO3+CO2↑+H2O△m
168g 106g 62g
x y 40g-33.8g=6.2g
x=
| 168g×6.2g |
| 62g |
生成的质量为m(Na2CO3)=
| 106g×6.2g |
| 62g |
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106g 22.4L
m 4.48L
m=
| 106g×4.48L |
| 22.4L |
故原混合物中碳酸钠的质量=21.2g-10.6g=10.6g,
所以原混合物中Na2CO3的质量分数为:
| 10.6g |
| 40g |
答:(1)原混合物中NaHCO3的质量为16.8;
(2)原混合物中Na2CO3的质量分数为26.5%.
点评:本题考查混合物的计算,题目难度中等,注意分析导致固体质量减小的原因,运用差量法计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于CO和N2的判断错误的是( )
| A、体积相等时质量一定相等 |
| B、电子数相等时具有相等的原子数 |
| C、同温同压下质子数相等则体积相等 |
| D、质量相等时具有相等的分子数 |
若1gN2中含有x个分子,则阿伏加德罗常数是( )
A、
| ||
B、
| ||
| C、14x mol-1 | ||
| D、28x mol-1 |






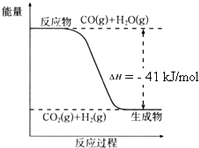 (1)根据如图写出热化学方程式:
(1)根据如图写出热化学方程式: