题目内容
将铁粉和氧化亚铁粉末的混合物共12.8克,加入到200毫升的稀硫酸中,恰好完全反应,得到氢气2.24升(标准状态).求:
(1)混合物中金属铁的质量分数?
(2)原稀硫酸的物质的量浓度?
(1)混合物中金属铁的质量分数?
(2)原稀硫酸的物质的量浓度?
考点:有关混合物反应的计算,铁的化学性质,铁的氧化物和氢氧化物
专题:计算题
分析:(1)根据n=
计算氢气的物质的量,反应的方程式为Fe+H2SO4=FeSO4+H2↑,根据生成氢气的物质的量可计算Fe的质量,进而计算Fe的质量分数;
(2)计算FeO的质量,反应后溶液中溶质为FeSO4,根据Fe元素、S元素守恒可计算硫酸的物质的量,进而计算浓度.
| V |
| Vm |
(2)计算FeO的质量,反应后溶液中溶质为FeSO4,根据Fe元素、S元素守恒可计算硫酸的物质的量,进而计算浓度.
解答:
解:(1)n(H2)=
=0.1mol,
Fe+H2SO4=FeSO4+H2↑
1 1
n(Fe) 0.1mol
所以n(Fe)=0.1mol,
m(Fe)=0.1mol×56g/mol=5.6g,
故Fe的质量分数=
×100%=43.75%,
答:混合物中金属Fe的质量分数为43.75%.
(2)m(FeO)=12.8g-5.6g=7.2g,n(FeO)=
=0.1mol,
溶质为硫酸亚铁,根据铁元素守恒n(FeSO4)=0.1mol+0.1mol=0.2mol,
所以n(H2SO4)=n(FeSO4)=0.2mol,
c(H2SO4)=
=1mol/L
答:原稀硫酸的物质的量浓度为1mol/L.
| 2.24L |
| 22.4L/mol |
Fe+H2SO4=FeSO4+H2↑
1 1
n(Fe) 0.1mol
所以n(Fe)=0.1mol,
m(Fe)=0.1mol×56g/mol=5.6g,
故Fe的质量分数=
| 5.6g |
| 12.8g |
答:混合物中金属Fe的质量分数为43.75%.
(2)m(FeO)=12.8g-5.6g=7.2g,n(FeO)=
| 7.2g |
| 72g/mol |
溶质为硫酸亚铁,根据铁元素守恒n(FeSO4)=0.1mol+0.1mol=0.2mol,
所以n(H2SO4)=n(FeSO4)=0.2mol,
c(H2SO4)=
| 0.2mol |
| 0.2L |
答:原稀硫酸的物质的量浓度为1mol/L.
点评:本题考查混合物的计算,题目难度不大,本题注意从质量守恒的角度解答.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
某温度下在密闭容器中发生如下反应:2SO2+O2?2SO3(g),若开始时只充入2mol SO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2mol SO2和1mol O2的混合气体,达到平衡时SO2的转化率为( )
| A、20% | B、40% |
| C、50% | D、60% |
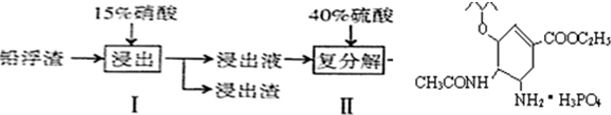
硫酸铅广泛应用于制造蓄电池、白色颜料等.利用锌冶炼过程中的铅浮渣(铅浮渣的主要成分是PbO、Pb还含有少量的Ag、Zn、CaO和其他不溶于硝酸的杂质)生产硫酸铅的流程如下:
下表是25°C时某些盐的浓度积常数,
下列说法不正确的是( )

下表是25°C时某些盐的浓度积常数,
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
| A、步骤I有NO产生,浸出液中含量最多的金属阳离子为Pb2+ |
| B、步骤I需控制硝酸的用量并使Pb稍有剩余,其目的是防止Ag被溶解进入溶液 |
| C、母液可循环利用于步骤I,其溶质主要是Pb(NO3)2 |
| D、产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去CaSO4 |
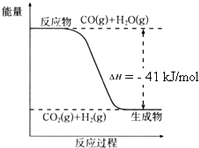 (1)根据如图写出热化学方程式:
(1)根据如图写出热化学方程式: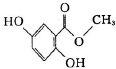
 ⑩
⑩ (11)
(11)