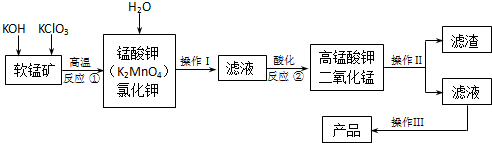
题目内容
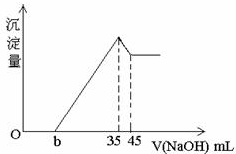 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.则原H2SO4物质的量溶度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.则原H2SO4物质的量溶度是( )| A、A、1mol/L |
| B、B、1.75mol/L |
| C、C、3.5mol/L |
| D、D、2mol/L |
考点:镁、铝的重要化合物,离子方程式的有关计算
专题:
分析:由图象可知,向滤液中加入bmL10mol/L的NaOH溶液,没有沉淀生成,说明硫酸有剩余,继续加入NaOH溶液,当加入氢氧化钠共35mL时,沉淀量最大,此时溶液溶质为硫酸钠,根据钠元素、硫酸根守恒有2n(H2SO4)=2n(Na2SO4)=n(NaOH),再根据公式计算原H2SO4物质的量浓度.
解答:
解:当加入氢氧化钠共35mL时,沉淀量最大,此时溶液溶质为硫酸钠,根据钠元素、硫酸根守恒有2n(H2SO4)=2n(Na2SO4)=n(NaOH)=0.035L×10mol/L=0.35mol,所以n(H2SO4)=0.175mol,故原H2SO4物质的量浓度为
=1.75mol/L.
故选B.
| 0.175mol |
| 0.1L |
故选B.
点评:本题考查化学计算,涉及方程式的计算、混合物的计算、图象计算等,难度中等,清楚图象各段反应是解题的关键.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A、7 g CnH2n中含氢原子数为NA | ||||
| B、4.6 g SO2、CO2混合气体中含有中子数为2.3NA | ||||
C、在反应2Na2O2+2 CO2
| ||||
| D、电解精炼铜时每转移NA个电子,阳极溶解32 g铜 |
下列物质所发生的化学反应中,由于反应物的用量不同而得到不同产物的是( )
①铁与稀硝酸
②AgNO3溶液与氨水溶液
③碳酸钠溶液与稀盐酸
④FeCl3溶液与Na2S溶液
⑤NaAlO2溶液和稀盐酸
⑥铁与氯气.
①铁与稀硝酸
②AgNO3溶液与氨水溶液
③碳酸钠溶液与稀盐酸
④FeCl3溶液与Na2S溶液
⑤NaAlO2溶液和稀盐酸
⑥铁与氯气.
| A、全部都是 | B、①②③⑤⑥ |
| C、①②③④⑤ | D、③④⑤ |
25℃时,0.1mol?L-1的某一元酸HA在水中有0.1%发生电离,下列说法不正确的是( )
| A、该溶液pH=4 |
| B、由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
| C、此酸的电离平衡常数约为1×10-7 mol?L-1 |
| D、升高温度,溶液的pH增大 |
对于常温下pH为4的氯化铵溶液与醋酸溶液,下列叙述正确的是( )
| A、溶液中c(H+)相等 |
| B、水电离的c(H+)相等 |
| C、两溶液中水的电离程度相等 |
| D、醋酸溶液中水电离的c(H+)多 |
 如图所示:
如图所示: