题目内容
A、B、C、D、E均是由下列10种离子组成的5种常见的可溶性化台物(离子不能重复组合).已知:
(1)元素X的原子结构示意图为 ;Y离子的电子式为 .
(2)通过所学的知识比较分析,就可判断其中必有的2种物质是 和 (填化学式).
(3)已知Z是常见的多核阴离子,现将(2)中确定的2种物质分别与Z的溶液混合时,一种产生红褐色沉淀和无色无气味的气体;另一种产生棕黄色沉淀,向该沉淀中滴人足量稀硝酸,沉淀部分溶解,剩余的沉淀为白色.则Z的化学式为 .
(4)含X的物质的水溶液中,所有离子物质的量浓度由大到小的顺序为 .
(5)将铜片投入到装有D溶液的试管中,铜片不溶解,再滴加稀硫酸,铜片逐渐溶解,试管口附近有红棕色气体出现,写出溶解铜片的离子方程式 .
| ①5种阳离子为:Mg2+、Ba2+、Fe3+、X、Y |
| ②5种阴离子为:OH-、Cl-、CO32-、NO3-、Z |
| ③X是短周期主族元素中金属性最强的元素形成的简单阳离子;Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的. |
(2)通过所学的知识比较分析,就可判断其中必有的2种物质是
(3)已知Z是常见的多核阴离子,现将(2)中确定的2种物质分别与Z的溶液混合时,一种产生红褐色沉淀和无色无气味的气体;另一种产生棕黄色沉淀,向该沉淀中滴人足量稀硝酸,沉淀部分溶解,剩余的沉淀为白色.则Z的化学式为
(4)含X的物质的水溶液中,所有离子物质的量浓度由大到小的顺序为
(5)将铜片投入到装有D溶液的试管中,铜片不溶解,再滴加稀硫酸,铜片逐渐溶解,试管口附近有红棕色气体出现,写出溶解铜片的离子方程式
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:X是短周期主族元素中金属性最强的元素形成的简单阳离子,即为Na+;Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的,即为Al3+,根据
离子共存的知识,结合以下小题,得到这五种物质是:Na2CO3、Ba(OH)2、Fe2(SO4)3,AlCl3、Mg(NO3)2,或是Na2CO3、Ba(OH)2、Fe2(SO4)3,Al(NO3)3、MgCl2,据此回答.
(1)钠原子结构示意图是: ,铝离子的电子式即为离子符号;
,铝离子的电子式即为离子符号;
(2)根据离子共存确定各个物质;
(3)根据产生红褐色沉淀是氢氧化铁,沉淀中滴人足量稀硝酸,沉淀部分溶解,剩余的沉淀为白色,即为硫酸钡来回答;
(4)碳酸钠的水溶液中,碳酸根离子会水解,导致溶液显示碱性,据此离子浓度来排序;
(5)金属Cu 不溶于稀硫酸中,但是可以溶解于稀硝酸中.
离子共存的知识,结合以下小题,得到这五种物质是:Na2CO3、Ba(OH)2、Fe2(SO4)3,AlCl3、Mg(NO3)2,或是Na2CO3、Ba(OH)2、Fe2(SO4)3,Al(NO3)3、MgCl2,据此回答.
(1)钠原子结构示意图是:
 ,铝离子的电子式即为离子符号;
,铝离子的电子式即为离子符号;(2)根据离子共存确定各个物质;
(3)根据产生红褐色沉淀是氢氧化铁,沉淀中滴人足量稀硝酸,沉淀部分溶解,剩余的沉淀为白色,即为硫酸钡来回答;
(4)碳酸钠的水溶液中,碳酸根离子会水解,导致溶液显示碱性,据此离子浓度来排序;
(5)金属Cu 不溶于稀硫酸中,但是可以溶解于稀硝酸中.
解答:
解:(1)X是短周期主族元素中金属性最强的元素形成的简单阳离子,即为Na+,钠原子结构示意图是: ,Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的,即为Al3+,电子式为Al3+,故答案为:
,Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的,即为Al3+,电子式为Al3+,故答案为: ;Al3+;
;Al3+;
(2)根据离子的共存知识,碳酸根离子只能和钠离子共存,剩下的氢氧根离子只能和钡离子共存,所以其中必有的2种物质是Na2CO3和Ba(OH)2,故答案为:Na2CO3;Ba(OH)2;
(3)将(2)中确定的2种物质Na2CO3、Ba(OH)2分别与Z的溶液混合时,一种产生红褐色沉淀:氢氧化铁和无色无气味的气体:二氧化碳;另一种产生棕黄色沉淀,向该沉淀中滴人足量稀硝酸,沉淀部分溶解,剩余的沉淀为白色:硫酸钡,则Z的化学式为:SO42-,故答案为:SO42-;
(4)碳酸钠的水溶液中,碳酸根离子会水解,导致溶液显示碱性,离子浓度大小顺序是:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(5)将铜片投入到装有D溶液即硝酸盐溶液的试管中,铜片不溶解,再滴加稀硫酸,铜片逐渐溶解,是因为通可以溶于硝酸的缘故,反应的实质是3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
 ,Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的,即为Al3+,电子式为Al3+,故答案为:
,Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的,即为Al3+,电子式为Al3+,故答案为: ;Al3+;
;Al3+;(2)根据离子的共存知识,碳酸根离子只能和钠离子共存,剩下的氢氧根离子只能和钡离子共存,所以其中必有的2种物质是Na2CO3和Ba(OH)2,故答案为:Na2CO3;Ba(OH)2;
(3)将(2)中确定的2种物质Na2CO3、Ba(OH)2分别与Z的溶液混合时,一种产生红褐色沉淀:氢氧化铁和无色无气味的气体:二氧化碳;另一种产生棕黄色沉淀,向该沉淀中滴人足量稀硝酸,沉淀部分溶解,剩余的沉淀为白色:硫酸钡,则Z的化学式为:SO42-,故答案为:SO42-;
(4)碳酸钠的水溶液中,碳酸根离子会水解,导致溶液显示碱性,离子浓度大小顺序是:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(5)将铜片投入到装有D溶液即硝酸盐溶液的试管中,铜片不溶解,再滴加稀硫酸,铜片逐渐溶解,是因为通可以溶于硝酸的缘故,反应的实质是3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评:本题综合考查学生离子的检验和共存知识,注意知识的归纳和整理是解题的关键,难度大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
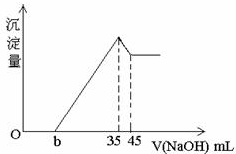 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.则原H2SO4物质的量溶度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.则原H2SO4物质的量溶度是( )| A、A、1mol/L |
| B、B、1.75mol/L |
| C、C、3.5mol/L |
| D、D、2mol/L |
同温同压下,两个体积相同的容器,一个盛有CO,另一个盛有O2、H2的混合气体,两瓶中气体一定具有相同的( )
| A、质量 | B、电子总数 |
| C、原子总数 | D、密度 |
在某一溶液中可能含有下列几种离子:K+、Fe3+、Ag+、Ba2+、NO2-、AlO2-、CO32-、SO32-、SO42-.某该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙.
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同.
下列说法正确的是( )
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙.
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同.
下列说法正确的是( )
| A、气体甲可能为CO2 或者SO2 |
| B、沉淀丙中一定含有BaCO3,可能含有BaSO4 |
| C、该溶液中肯定存在的离子有K+、AlO2-、SO32-、SO42-、NO2- |
| D、只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定 |
下列各组反应中最终肯定不生成白色沉淀的是( )
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、MgCl2溶液中加入过量氨水 |
| D、澄清石灰水中通入过量CO2 |