题目内容
下列物质所发生的化学反应中,由于反应物的用量不同而得到不同产物的是( )
①铁与稀硝酸
②AgNO3溶液与氨水溶液
③碳酸钠溶液与稀盐酸
④FeCl3溶液与Na2S溶液
⑤NaAlO2溶液和稀盐酸
⑥铁与氯气.
①铁与稀硝酸
②AgNO3溶液与氨水溶液
③碳酸钠溶液与稀盐酸
④FeCl3溶液与Na2S溶液
⑤NaAlO2溶液和稀盐酸
⑥铁与氯气.
| A、全部都是 | B、①②③⑤⑥ |
| C、①②③④⑤ | D、③④⑤ |
考点:铁的化学性质,氨的化学性质,硝酸的化学性质,钠的重要化合物,镁、铝的重要化合物
专题:元素及其化合物
分析:①铁的用量不同,产物不同;
②氨水的用量不同,产物不同;
③碳酸钠溶液与稀盐酸反应,可生成碳酸氢钠或二氧化碳气体,产物不同;
④FeCl3溶液与Na2S溶液发生氧化还原反应,硫化钠的量不同,其产物不同;
⑤NaAlO2溶液和稀盐酸反应,量不同,产物不同;
⑥铁与氯气反应只生成氯化铁.
②氨水的用量不同,产物不同;
③碳酸钠溶液与稀盐酸反应,可生成碳酸氢钠或二氧化碳气体,产物不同;
④FeCl3溶液与Na2S溶液发生氧化还原反应,硫化钠的量不同,其产物不同;
⑤NaAlO2溶液和稀盐酸反应,量不同,产物不同;
⑥铁与氯气反应只生成氯化铁.
解答:
解:①铁与稀硝酸时,铁不足时生成硝酸铁,铁过量时生成硝酸亚铁,故①正确;
②氨水不足时生成沉淀,过量时生成银氨溶液,故②正确;
③碳酸钠溶液与稀盐酸反应,可生成碳酸氢钠或二氧化碳气体,产物不同,故③正确;
④FeCl3溶液与Na2S溶液发生氧化还原反应,当硫化钠少量时,二者反应生成亚铁离子和S,当硫化钠过量时,亚铁离子和硫离子反应生成FeS沉淀,与量有关,故④正确;
⑤NaAlO2溶液和稀盐酸反应,盐酸少量时生成氢氧化铝,过量时生成氯化铝,故⑤正确;
⑥铁与氯气反应只生成氯化铁,与量无关,故⑥错误;
故选C.
②氨水不足时生成沉淀,过量时生成银氨溶液,故②正确;
③碳酸钠溶液与稀盐酸反应,可生成碳酸氢钠或二氧化碳气体,产物不同,故③正确;
④FeCl3溶液与Na2S溶液发生氧化还原反应,当硫化钠少量时,二者反应生成亚铁离子和S,当硫化钠过量时,亚铁离子和硫离子反应生成FeS沉淀,与量有关,故④正确;
⑤NaAlO2溶液和稀盐酸反应,盐酸少量时生成氢氧化铝,过量时生成氯化铝,故⑤正确;
⑥铁与氯气反应只生成氯化铁,与量无关,故⑥错误;
故选C.
点评:本题考查物质间的化学反应,综合考查元素化合物知识,把握量对化学反应的影响为解答的关键,注意发生的氧化还原反应及复分解反应,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
通常把原子总数和价电子总数相同的分子或离子称为等电子体.等电子体具有相似的化学结构,则下列有关说法中正确的是( )
| A、CH4和NH4+是等电子体,化学键类型完全相同 |
| B、NO3-和CO32-是等电子体,均为平面正三角形结构 |
| C、H3O+和PCl3是等电子体,均为三角锥形结构 |
| D、SO2和O3是等电子体,SO2和O3具有相同的化学性质 |
下列实验操作或记录正确的是( )
| A、用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |
| B、用100 mL量筒测得排水法收集制得的氢气体积为50.28 mL |
| C、用广泛PH试纸测得某雨水的PH为5.6 |
| D、做过焰色反应的金属丝应用稀盐酸洗,再灼烧 |
分子式为C9H12的芳香烃,其可能的结构有( )
| A、5种 | B、6种 | C、7种 | D、8种 |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( )
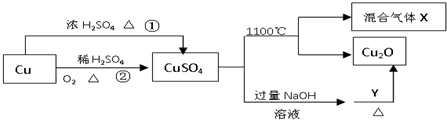

| A、相对于途径①,途径②更好地体现了绿色化学思想 |
| B、Y可以是蔗糖溶液 |
| C、CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| D、将CuSO4溶液蒸发、利用余热蒸干,可制得胆矾晶体 |
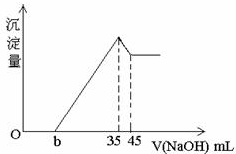 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.则原H2SO4物质的量溶度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.则原H2SO4物质的量溶度是( )| A、A、1mol/L |
| B、B、1.75mol/L |
| C、C、3.5mol/L |
| D、D、2mol/L |
下列各组反应中最终肯定不生成白色沉淀的是( )
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、MgCl2溶液中加入过量氨水 |
| D、澄清石灰水中通入过量CO2 |