题目内容
25℃时,0.1mol?L-1的某一元酸HA在水中有0.1%发生电离,下列说法不正确的是( )
| A、该溶液pH=4 |
| B、由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
| C、此酸的电离平衡常数约为1×10-7 mol?L-1 |
| D、升高温度,溶液的pH增大 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A.c(H+)=0.1mol?L-1×0.1%=10-4mol/L,pH=-lgc(H+);
B.水电离出的c(H+)等于溶液中c(OH-);
C.电离平衡常数K=
;
D.升高温度促进HA电离,溶液中氢离子浓度增大.
B.水电离出的c(H+)等于溶液中c(OH-);
C.电离平衡常数K=
| c(H+).c(A-) |
| c(HA) |
D.升高温度促进HA电离,溶液中氢离子浓度增大.
解答:
解:A.c(H+)=0.1mol?L-1×0.1%=10-4mol/L,pH=-lg10-4=4,故A正确;
B.水电离出的c(H+)等于溶液中c(OH-)=
mol/L=10-10mol/L,由HA电离出的c(H+)为10-4mol/L,所以由HA电离出的c(H+)约为水电离出的c(H+)的106倍,故B正确;
C.电离平衡常数K=
=
mol/=1×10-7 mol?L-1,故C正确;
D.HA的电离是吸热反应,升高温度促进HA电离,溶液中氢离子浓度增大,则溶液的pH减小,故D错误;
故选D.
B.水电离出的c(H+)等于溶液中c(OH-)=
| 10-14 |
| 10-4 |
C.电离平衡常数K=
| c(H+).c(A-) |
| c(HA) |
| 10-4×10-4 |
| 0.1 |
D.HA的电离是吸热反应,升高温度促进HA电离,溶液中氢离子浓度增大,则溶液的pH减小,故D错误;
故选D.
点评:本题考查弱电解质的电离,涉及pH计算、溶液中水电离及电离平衡常数的计算,侧重考查学生分析问题、计算能力,难点是水电离出氢离子浓度的计算,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验操作或记录正确的是( )
| A、用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |
| B、用100 mL量筒测得排水法收集制得的氢气体积为50.28 mL |
| C、用广泛PH试纸测得某雨水的PH为5.6 |
| D、做过焰色反应的金属丝应用稀盐酸洗,再灼烧 |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( )
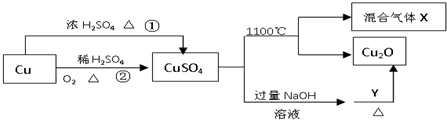

| A、相对于途径①,途径②更好地体现了绿色化学思想 |
| B、Y可以是蔗糖溶液 |
| C、CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| D、将CuSO4溶液蒸发、利用余热蒸干,可制得胆矾晶体 |
 图中X、Y分别是直流电源的两极,通电后,发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
图中X、Y分别是直流电源的两极,通电后,发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )| a极板 | b极板 | X电极 | Z溶液 | |
| A | 银 | 铁 | 正极 | AgNO3 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 锌 | 石墨 | 负极 | CuSO4 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
| A、A |
| B、B |
| C、C |
| D、D |
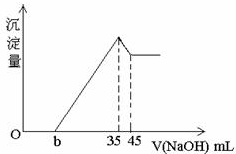 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.则原H2SO4物质的量溶度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.则原H2SO4物质的量溶度是( )| A、A、1mol/L |
| B、B、1.75mol/L |
| C、C、3.5mol/L |
| D、D、2mol/L |
在某一溶液中可能含有下列几种离子:K+、Fe3+、Ag+、Ba2+、NO2-、AlO2-、CO32-、SO32-、SO42-.某该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙.
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同.
下列说法正确的是( )
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙.
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同.
下列说法正确的是( )
| A、气体甲可能为CO2 或者SO2 |
| B、沉淀丙中一定含有BaCO3,可能含有BaSO4 |
| C、该溶液中肯定存在的离子有K+、AlO2-、SO32-、SO42-、NO2- |
| D、只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定 |
下列各选项所描述的两个量,前者一定大于后者的是( )
| A、纯水在25℃和80℃时的pH值 |
| B、25℃时,pH=3的盐酸和AlCl3溶液中,水电离的氢离子的浓度 |
| C、耐火材料CaO和MgO的熔点 |
| D、1L pH=2的盐酸和醋酸溶液中,分别投入足量锌粒,放出H2的物质的量 |