题目内容
在实验室易燃品橱柜里有一瓶失去标签的试剂,某同学为探究其成分,进行如下实验分析:取4.4g该物质,使其充分燃烧,测知只生成3.6g水和8.8g二氧化碳.请你通过计算回答:
(1)该物质中一定含什么元素?
(2)该物质中各元素的质量比是多少? .
(1)该物质中一定含什么元素?
(2)该物质中各元素的质量比是多少?
考点:有关有机物分子式确定的计算
专题:有机物分子组成通式的应用规律
分析:根据原子守恒可知,该物质一定含有C、H元素,根据C元素质量分数、H元素质量分数计算C、H元素质量,再根据守恒判断该物质是否含有氧元素,若含有氧元素,计算氧元素质量,进而计算各元素质量之比.
解答:
解:(1)根据原子守恒可知,该物质一定含有C、H元素,
氢元素的质量为 3.6g×
=0.4g;
碳元素的质量=8.8g×
×=2.4g;
由于0.4g+2.4g=2.8g<4.4g,故该物质含有O元素,即该物质含有C、H、O三种元素,
故答案为:C、H、O;
(2)4.4g该物质含有O元素质量=4.4g-0.4g-2.4g=1.6g,故该物质含有C、H、O元素质量之比=2.4g:0.4g:1.6g=6:1:4,
故答案为:m(C):m(H):m(O)=6:1:4.
氢元素的质量为 3.6g×
| 2 |
| 18 |
碳元素的质量=8.8g×
| 12 |
| 44 |
由于0.4g+2.4g=2.8g<4.4g,故该物质含有O元素,即该物质含有C、H、O三种元素,
故答案为:C、H、O;
(2)4.4g该物质含有O元素质量=4.4g-0.4g-2.4g=1.6g,故该物质含有C、H、O元素质量之比=2.4g:0.4g:1.6g=6:1:4,
故答案为:m(C):m(H):m(O)=6:1:4.
点评:本题考查质量守恒定律应用,难度不大,注意从宏观与微观方面理解质量守恒定律.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
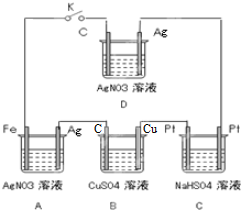
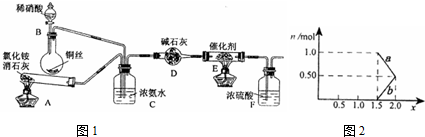
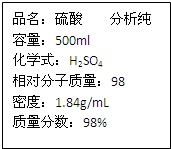 用标签如右图的浓硫酸配置500mL0.5mol?L-1稀硫酸,请回答下列问题:
用标签如右图的浓硫酸配置500mL0.5mol?L-1稀硫酸,请回答下列问题: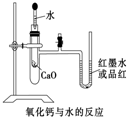 如图是某同学设计的放热反应的观察装置.其实验顺序是:①按图所示将实验装置
如图是某同学设计的放热反应的观察装置.其实验顺序是:①按图所示将实验装置