题目内容
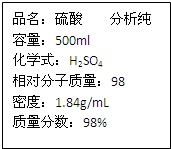 用标签如右图的浓硫酸配置500mL0.5mol?L-1稀硫酸,请回答下列问题:
用标签如右图的浓硫酸配置500mL0.5mol?L-1稀硫酸,请回答下列问题:①该浓硫酸物质的量浓度为
②配制该稀硫酸,需要浓硫酸
③如果实验室中有15mL,20mL,50mL的量筒,应选用
或无影响)
考点:溶液的配制
专题:实验题
分析:①根据c=
计算该浓硫酸的物质的量浓度;
②根据稀释定律计算需要浓硫酸的体积;
③依据②计算结果选择量筒的规格,要求“大而近”,用水洗涤后直接量取浓硫酸,会导致实际量取的浓硫酸体积偏小,所配溶液浓度偏下.
| 1000ρω |
| M |
②根据稀释定律计算需要浓硫酸的体积;
③依据②计算结果选择量筒的规格,要求“大而近”,用水洗涤后直接量取浓硫酸,会导致实际量取的浓硫酸体积偏小,所配溶液浓度偏下.
解答:
解:①该瓶浓硫酸的物质的量浓度为
mol/L=18.4mol/L,
故答案为:18.4;
②令需要该浓硫酸的体积为V,根据稀释定律,稀释前后溶质硫酸的物质的量不变,则:
V×18.4mol/L=500mL×0.5mol/L,
解得:V=13.6mL,
故答案为:13.6;
③由②计算可知需要浓硫酸13.6ml,因此选用15ml量筒,量筒用水洗涤后直接量取浓硫酸13.5ml,会导致实际量取的浓硫酸体积偏小,所配溶液浓度偏下,
故答案为:15;13.6;偏低.
| 1000×1.84×98% |
| 98 |
故答案为:18.4;
②令需要该浓硫酸的体积为V,根据稀释定律,稀释前后溶质硫酸的物质的量不变,则:
V×18.4mol/L=500mL×0.5mol/L,
解得:V=13.6mL,
故答案为:13.6;
③由②计算可知需要浓硫酸13.6ml,因此选用15ml量筒,量筒用水洗涤后直接量取浓硫酸13.5ml,会导致实际量取的浓硫酸体积偏小,所配溶液浓度偏下,
故答案为:15;13.6;偏低.
点评:本题考查物质的量浓度的有关计算,难度不大,注意对公式的理解与灵活运用,注意掌握物质的量浓度与质量分数的关系、误差分析.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
 为了验证同浓度同体积的盐酸和醋酸的酸性不同,在同温同压下,设计如下实验:
为了验证同浓度同体积的盐酸和醋酸的酸性不同,在同温同压下,设计如下实验: