题目内容
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的有几项( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了;
②用滴定管量取液体时,开始时平视读数,结束时俯视读数;
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤;
④转移溶液前容量瓶内有少量蒸馏水;
⑤定容时,仰视容量瓶的刻度线;
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线;
⑦用量筒量取一定量浓硫酸配制稀硫酸,转移到烧杯后,用少量水洗涤量筒;
⑧在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中.
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了;
②用滴定管量取液体时,开始时平视读数,结束时俯视读数;
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤;
④转移溶液前容量瓶内有少量蒸馏水;
⑤定容时,仰视容量瓶的刻度线;
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线;
⑦用量筒量取一定量浓硫酸配制稀硫酸,转移到烧杯后,用少量水洗涤量筒;
⑧在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中.
| A、4项 | B、5项 | C、6项 | D、7项 |
考点:溶液的配制
专题:实验评价题
分析:分析操作对溶质物质的量、溶液体积的影响,根据c=
判断对所配溶液浓度的影响.
| n |
| V |
解答:
解:①被称量物与砝码的位置放颠倒了,会导致称量出的药品的质量变小,故所配溶液浓度偏低;
②滴定管量取液体时,开始时平视读数,结束时俯视读数,会导致所取溶液体积偏大,所配溶液浓度偏高;
③移液后烧杯及玻璃棒未用蒸馏水洗涤,会导致溶质的损失,故使所配溶液浓度偏低;
④转移溶液前容量瓶内有少量蒸馏水对所配溶液的浓度无影响;
⑤定容时,仰视容量瓶的刻度线,会导致溶液体积偏大,故使所配溶液浓度偏低;
⑥定容后摇匀,发现液面降低,这是因为容量瓶的塞子会有溶液沾留,是正常的,又补加少量水,重新达到刻度线,这会使所配溶液浓度偏低;
⑦用少量水洗涤量筒,会导致浓硫酸的量取多了,故会使所配溶液浓度偏高;
⑧NaOH固体的溶解放热,故在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中并定容的话,会导致冷却后液面低于刻度线,溶液体积偏小,浓度偏高.
所配溶液浓度偏低的有4项,
故选A.
②滴定管量取液体时,开始时平视读数,结束时俯视读数,会导致所取溶液体积偏大,所配溶液浓度偏高;
③移液后烧杯及玻璃棒未用蒸馏水洗涤,会导致溶质的损失,故使所配溶液浓度偏低;
④转移溶液前容量瓶内有少量蒸馏水对所配溶液的浓度无影响;
⑤定容时,仰视容量瓶的刻度线,会导致溶液体积偏大,故使所配溶液浓度偏低;
⑥定容后摇匀,发现液面降低,这是因为容量瓶的塞子会有溶液沾留,是正常的,又补加少量水,重新达到刻度线,这会使所配溶液浓度偏低;
⑦用少量水洗涤量筒,会导致浓硫酸的量取多了,故会使所配溶液浓度偏高;
⑧NaOH固体的溶解放热,故在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中并定容的话,会导致冷却后液面低于刻度线,溶液体积偏小,浓度偏高.
所配溶液浓度偏低的有4项,
故选A.
点评:本题考查一定物质的量浓度溶液的配制,难度不大,注意浓硫酸的稀释,根据c=
理解溶液配制原理与误差分析.
| n |
| V |

练习册系列答案
相关题目
提出有机化学概念,使有机化学逐渐发展成为化学的一个重要分支的科学家是( )
| A、维勒 | B、贝采利乌斯 |
| C、李比希 | D、科里 |
甲、乙、丙、丁中学化学中常见的物质,甲为黑色粉末、乙是白色粉末、丙是黄绿色气体、丁是无色能使带火星的木条复燃的气体各物质间转化关系如图,下列说法正确的是( )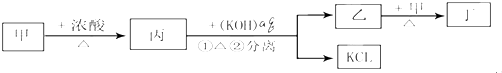
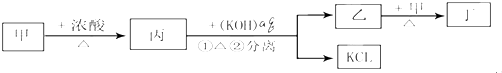
| A、无甲 时乙一定不能生成丁; | ||||
B、甲生成丁的离子方程式为:MnO2+4H++2Cl-
| ||||
C、丙和KOH的反应离子方程式为:Cl2+2OH-
| ||||
| D、电解饱和KCl溶液可生成KOH,并同时生成丙和丁. |
某强酸性溶液中含有Fe3+、Mg2+,在此溶液中还能存在的离子组是( )
| A、K+、Na+、HCO3-、SO42- |
| B、OH-、K+、Cu2+、NO3- |
| C、K+、SCN-、I-、Na+ |
| D、K+、SO42-、Na+、NO3- |
下列电离方程式中,正确的是( )
| A、NaNO3=Na++NO3- | ||
| B、Ba(OH)2=Ba2++OH- | ||
C、MgSO4═Mg+2+S
| ||
| D、H2SO4=H2++SO42- | ||
| E、H2SO4=H2++SO42- |
 为了验证同浓度同体积的盐酸和醋酸的酸性不同,在同温同压下,设计如下实验:
为了验证同浓度同体积的盐酸和醋酸的酸性不同,在同温同压下,设计如下实验: