题目内容
如图所示的装置,闭合开关一段时间后,再断开,请回答问题.在此过程中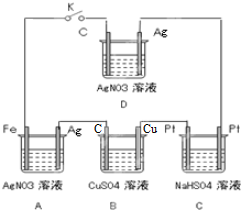
(1)A中发生反应的离子方程式是 ,其中Fe电极的名称是
(2)若B中溶液仍为蓝色,其中一电极增重1.6g,则增重的是B中的 (填“C”或“Cu”)电极,电解后溶液的pH为 ;要使电解后溶液恢复到电解前的状态,则需加入 (填化学式),其质量为 .(假设电解前后溶液的体积500ml不变)
(3)断开开关后,发现C中溶液的PH值 (填“增大”、“减小”或“不变”),其通电过程中阳极发生的反应是
(4)此过程中D中的铜电极质量 ,银电极质量 ,电解质溶液浓度 (填“增大”、“减小”或“不变”)

(1)A中发生反应的离子方程式是
(2)若B中溶液仍为蓝色,其中一电极增重1.6g,则增重的是B中的
(3)断开开关后,发现C中溶液的PH值
(4)此过程中D中的铜电极质量
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)A中Fe与银离子反应生成亚铁离子和Ag,Fe比Ag活泼作负极;
(2)阴极上铜离子得电子生成铜单质质量增大;根据电解方程式结合电子守恒计算;阴极铜离子放电,阳极氢氧根离子放电,然后根据析出的物质向溶液中加入它们形成的化合物即可;根据生成的Cu和氧气的质量计算;
(3)电解硫酸氢钠溶液实质是电解水,根据溶液的体积变化判断pH;阳极上氢氧根离子失电子;
(4)D中Cu与负极相连为阴极,Cu上银离子得电子,Ag与正极相连为阳极,阳极上Ag失电子,根据两极的反应判断溶液浓度的变化.
(2)阴极上铜离子得电子生成铜单质质量增大;根据电解方程式结合电子守恒计算;阴极铜离子放电,阳极氢氧根离子放电,然后根据析出的物质向溶液中加入它们形成的化合物即可;根据生成的Cu和氧气的质量计算;
(3)电解硫酸氢钠溶液实质是电解水,根据溶液的体积变化判断pH;阳极上氢氧根离子失电子;
(4)D中Cu与负极相连为阴极,Cu上银离子得电子,Ag与正极相连为阳极,阳极上Ag失电子,根据两极的反应判断溶液浓度的变化.
解答:
解:(1)A中Fe与银离子反应生成亚铁离子和Ag,其反应的离子方程式为:2Ag++Fe=Fe2++2Ag,Fe比Ag活泼,则Fe失电子发生氧化反应作负极;
故答案为:2Ag++Fe=Fe2++2Ag;负极;
(2)若B中溶液仍为蓝色,其中一电极增重1.6g,阴极上铜离子得电子生成铜单质质量增大,则增重的是Cu电极;根据2Cu2++2H2O
Cu+O2↑+4H+知,析出1.6gCu,即
=0.025mol,则溶液中生成的氢离子为0.05mol,则c(H+)=0.1mol/L,所以溶液的pH=1,阳极上生成氧气、阴极上生成铜,实质上相当于生成CuO,要使溶液恢复原状,应该加入CuO,根据Cu原子守恒得m(CuO)=0.025mol×80g/mol=2g;
故答案为:Cu;1;CuO;2;
(3)电解硫酸氢钠溶液实质是电解水,水减少,则溶液的体积减小,所以溶液酸性增强,则pH减小;阳极上氢氧根离子失电子,则阳极上电极反应式为:4OH--4e-=2H2O+O2↑;
故答案为:减小;4OH--4e-=2H2O+O2↑;
(4)D中Cu与负极相连为阴极,Cu上银离子得电子生成银单质,则Cu电极质量增大,Ag与正极相连为阳极,阳极上Ag失电子生成银离子,则银电极质量减小,两极上生成的银离子和消耗的阴离子相同,则反应后溶液浓度不变;
故答案为:增大;减小;不变.
故答案为:2Ag++Fe=Fe2++2Ag;负极;
(2)若B中溶液仍为蓝色,其中一电极增重1.6g,阴极上铜离子得电子生成铜单质质量增大,则增重的是Cu电极;根据2Cu2++2H2O
| ||
| 1.6g |
| 64g/mol |
故答案为:Cu;1;CuO;2;
(3)电解硫酸氢钠溶液实质是电解水,水减少,则溶液的体积减小,所以溶液酸性增强,则pH减小;阳极上氢氧根离子失电子,则阳极上电极反应式为:4OH--4e-=2H2O+O2↑;
故答案为:减小;4OH--4e-=2H2O+O2↑;
(4)D中Cu与负极相连为阴极,Cu上银离子得电子生成银单质,则Cu电极质量增大,Ag与正极相连为阳极,阳极上Ag失电子生成银离子,则银电极质量减小,两极上生成的银离子和消耗的阴离子相同,则反应后溶液浓度不变;
故答案为:增大;减小;不变.
点评:本题考查了原电池原理和电解原理的应用,先根据能自发发生的氧化还原反应判断原电池,再根据原电池的正负极判断电解池的阴阳极,结合离子放电顺序分析判断,再结合原子守恒进行计算,题目难度中等.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
某强酸性溶液中含有Fe3+、Mg2+,在此溶液中还能存在的离子组是( )
| A、K+、Na+、HCO3-、SO42- |
| B、OH-、K+、Cu2+、NO3- |
| C、K+、SCN-、I-、Na+ |
| D、K+、SO42-、Na+、NO3- |