题目内容
定量分析是化学实验中重要的组成部分.根据所学知识回答下列实验:
中和热的测定:
(1)在实验室中,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液反应测定中和热.假设此时溶液密度均为1g/cm3,生成溶液的比容热c=4.18J/(g?℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式△H= .
(2)1L 1mol/L H2SO4溶液与2L 1mol/L NaOH溶液完全反应,放出114.6kJ的热量.请写出表示该反应中和热的热化学方程式 .
中和热的测定:
(1)在实验室中,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液反应测定中和热.假设此时溶液密度均为1g/cm3,生成溶液的比容热c=4.18J/(g?℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式△H=
(2)1L 1mol/L H2SO4溶液与2L 1mol/L NaOH溶液完全反应,放出114.6kJ的热量.请写出表示该反应中和热的热化学方程式
考点:有关反应热的计算,热化学方程式
专题:化学反应中的能量变化
分析:(1)根据Q=△H=m?c?△T计算;
(2)根据热化学方程式中系数和焓变的关系来书写热化学方程式.
(2)根据热化学方程式中系数和焓变的关系来书写热化学方程式.
解答:
解:(1)根据Q=△H=m?c?△T,中和热的计算式△H=-4.18J/(g?℃)×100mL×1g/cm3(T2-T1),故答案为:-4.18J/(g?℃)×100mL×1g/cm3(T2-T1);
(2)根据稀1L 1mol/L H2SO4溶液与2L 1mol/L NaOH溶液完全反应,放出114.6kJ的热量的热化学方程式为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l),△H=-114.6kJ/mol,
故答案为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l),△H=-114.6kJ/mol.
(2)根据稀1L 1mol/L H2SO4溶液与2L 1mol/L NaOH溶液完全反应,放出114.6kJ的热量的热化学方程式为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l),△H=-114.6kJ/mol,
故答案为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l),△H=-114.6kJ/mol.
点评:本题考查热化学方程式以及反应热的计算,题目难度中等,注意理解中和热的概念、把握热化学方程式的书写方法,以及利用化学方程式计算反应热等问题.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
甲、乙、丙、丁中学化学中常见的物质,甲为黑色粉末、乙是白色粉末、丙是黄绿色气体、丁是无色能使带火星的木条复燃的气体各物质间转化关系如图,下列说法正确的是( )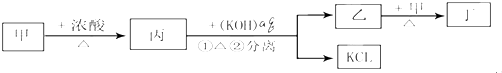
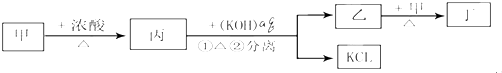
| A、无甲 时乙一定不能生成丁; | ||||
B、甲生成丁的离子方程式为:MnO2+4H++2Cl-
| ||||
C、丙和KOH的反应离子方程式为:Cl2+2OH-
| ||||
| D、电解饱和KCl溶液可生成KOH,并同时生成丙和丁. |