题目内容
充分燃烧一定量的丁烷放出的热量大小为Q,生成的CO2恰好与100mL浓度为5mol/L的KOH溶液完全反应.则燃烧1mol丁烷放出的热量为 .
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:CO2恰好与KOH溶液完全反应生成正盐为K2CO3,根据n=cV计算KOH的物质的量,根据钾元素守恒计算n(K2CO3),根据碳元素守恒由n(CO2)=n(K2CO3),进而计算丁烷的物质的量;
CO2恰好与KOH溶液完全反应生成酸式盐为KHCO3,根据n=cV计算KOH的物质的量,根据钾元素守恒计算n(KHCO3),据碳元素守恒由n(CO2)=n(KHCO3),进而计算丁烷的物质的量,据此计算.
CO2恰好与KOH溶液完全反应生成酸式盐为KHCO3,根据n=cV计算KOH的物质的量,根据钾元素守恒计算n(KHCO3),据碳元素守恒由n(CO2)=n(KHCO3),进而计算丁烷的物质的量,据此计算.
解答:
解:KOH的物质的量为0.1L×5mol/L=0.5mol,若是K2CO3,据钾离子守恒,故n(K2CO3)=0.5mol×
=0.25mol,根据碳元素守恒由n(CO2)=n(K2CO3)=0.25mol,根据碳元素守恒可知,n(C4H10)=
n(CO2)=
×0.25mol=
mol,
mol丁烷放出的热量为Q,故1mol丁烷完全燃烧放出的热量为QkJ×16=16kJ;
若是KHCO3,据钾离子守恒,n(KHCO3)=0.5mol,根据碳元素守恒由n(CO2)=n(KHCO3)=0.5mol,根据碳元素守恒可知,n(C4H10)=
n(CO2)=0.5mol×
=0.125mol,即0.125mol丁烷放出的热量大小为QkJ,故1mol丁烷完全燃烧放出的热量为QkJ×8=8QkJ;
1mol丁烷完全燃烧放出的热量Q的范围为为16QkJ或8QkJ,
故答案为:16QkJ或8QkJ.
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 16 |
| 1 |
| 16 |
若是KHCO3,据钾离子守恒,n(KHCO3)=0.5mol,根据碳元素守恒由n(CO2)=n(KHCO3)=0.5mol,根据碳元素守恒可知,n(C4H10)=
| 1 |
| 4 |
| 1 |
| 4 |
1mol丁烷完全燃烧放出的热量Q的范围为为16QkJ或8QkJ,
故答案为:16QkJ或8QkJ.
点评:本题考查反应热的有关的计算,难度中等,根据产物计算丁烷的物质的量是解答该题的关键.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
下列实验中能达到相应目的是( )
A、 吸收氨气制氨水 |
B、 制取少量蒸馏水 |
C、 转移溶液 |
D、 除去杂质气体CO2 |
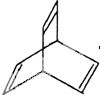 I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写
I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写 为.有机物X的键线式如图:
为.有机物X的键线式如图: