题目内容
1.铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程: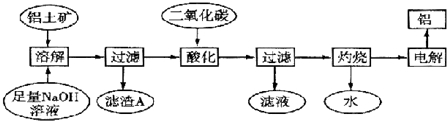
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为2OH-+Al2O3═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O.
(2)滤渣A的主要成分是Fe2O3、Na2Al2SiO8;硅铝酸盐沉淀写成氧化物的形式是Na2O•Al2O3.•2SiO2.
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是盐酸是强酸,Al(OH)3溶于强酸而不溶于弱酸,通入二氧化碳是为了提高Al2O3的提取率.
(4)若该工厂用mkg铝土矿共制得nkg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为5100n/27m%或 1700n/9m%.
(5)若将铝溶解,下列试剂中最好选用B(填编号).
A.浓硫酸B. 稀硫酸C.稀HNO3 D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是[AlF6]3-,配位数为6.
分析 (1)Al2O3是两性氢氧化物,SiO2是酸性氧化物,都要与强碱反应生成盐和水.
(2)Al2O3、SiO2、Fe2O3用碱溶的方法分开.首先除掉不反应的Fe2O3,根据题中已知条件②除掉Na2SiO3.从而生成Na2Al2Si2O8,所以滤渣有两种.氧化物的形式是:金属氧化物•非金属氧化物•水,注意活泼金属氧化物写在前,注意原子个数的比例与原化学式中相同.
(3)通入二氧化碳酸化将NaAlO2转化成Al(OH)3,考查了氢氧化铝溶于强酸不溶于弱酸的知识.
(4)计算质量分数时用原子守恒法解,这是关系式:2Al~Al2O3,已知铝的质量,可算出铝的物质的量n(Al),再利用关系式算三氧化二铝的物质的量,n(Al2O3)=$\frac{1}{2}$n(Al),
Al2O3的质量为m=n(Al2O3)•M(Al2O3),所以Al2O3的质量分数为Al2O3的质量除以铝土矿的总质量.
(5)铁、铝遇浓硫酸、浓硝酸会钝化,稀硝酸与铝反应产生有毒气体.
(6)在配合物中,内界是配位单元,含配位键,内界是复杂离子,外界是简单离子;配位原子是提供孤对电子的原子,配位数是配位原子的数目.
解答 解:(1)Al2O3是两性氢氧化物,SiO2是酸性氧化物,都要与强碱反应生成盐和水.
故答案为:2OH-+Al2O3═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O
(2)由于氢氧化钠是足量的,所以Al2O3和SiO2充分反应,生成Na2SiO3和NaAlO2,
而铝土矿的主要成分是Al2O3,SiO2少量,那么生成的Na2SiO3少,NaAlO2多,
发生反应2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH后,
滤渣有之前不反应的Fe2O3和生成的Na2Al2Si2O8,滤液中有NaOH、余下大量的NaAlO2;
氧化物的形式是:金属氧化物•非金属氧化物•水,注意活泼金属氧化物写在前,注意原子个数的比例与原化学式中相同,
写成Na2O•Al2O3.•2SiO2.
故答案为 Fe2O3、Na2Al2Si2O8 Na2O•Al2O3.•2SiO2
(3)从第2小题的分析可知滤液中的NaAlO2要转化成Al(OH)3不能用盐酸,盐酸是强酸,
强酸过量后Al(OH)3会溶解.
故答案为:盐酸是强酸,Al(OH)3溶于强酸而不溶于弱酸,通入二氧化碳是为了提高Al2O3的提取率.
(4)已知铝nkg,可算出铝的物质的量,n(Al)=$\frac{1000n}{27}$ mol,根据原子守恒:2Al~Al2O3,三氧化二铝的物质的量n(Al2O3)=$\frac{1}{2}$n(Al),
n(Al2O3)=$\frac{1000n}{27×2}$,所以Al2O3的质量为
m=n(Al2O3)•M(Al2O3)=$\frac{1000n}{27×2}$ mol×102 g•mol-1 =$\frac{51000n}{27}$ g,所以Al2O3的质量分数为Al2O3的质量除以铝土矿的总质量,即$\frac{51000n}{27}$÷1000m=$\frac{51n}{27m}$;质量分数一般要乘以100%.
故答案为:$\frac{5100n}{27m}$% 或$\frac{1700n}{9m}$%.
(5)铁、铝遇浓硫酸、浓硝酸会钝化,稀硝酸与铝反应产生有毒气体,且等量的铝溶解消耗稀硝酸更多,消耗稀硫酸更少,从环保、节约的角度考虑,应用稀硫酸溶解铝.
故选B.
(6)在配合物中,内界是配位单元,含配位键,内界是复杂离子,外界是简单离子;配位原子是提供孤对电子的原子,配位数是配位原子的数目,这里的配位原子是氟原子,有6个.
故答案为:[AlF6]3-;6.
点评 除掉Fe2O3不难分析,关键是SiO2转化成Na2SiO3后,怎样除掉Na2SiO3?学生不能用题中信息解决这个问题.计算质量分数时利用原子守恒这是解题常用的方法,在处理数据以及单位时要特别小心.浓硫酸与浓硝酸的强氧化性的考查,同时要求学生要有化学与环境保护的思想.配位化合物的考查一般都很简单.

| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
| A. | CH3CH2CH2CH2OH | B. | CH3CH2OH | ||
| C. |  | D. |  |
(1)若要增大M的转化率,在其他条件不变的情况下可以采取的措施为BC(填字母).
A.加入一定量M B.加入一定量N
| 温度/℃ | 600 | 700 |
| 平衡常数 | K1 | K2 |
D.缩小反应容器的体积
(2)不同温度下该反应的平衡常数如下:则K1< (填“>”或“<”)K2.
(3)某温度下,反应物的起始浓度[M]=1.0mol•L-1,[N]=2.4mol•L-1,达到平衡后,M的转化率为60%,此时N的转化率为25%,该反应的平衡常数Kc=0.5.

| A. | V=40 | |
| B. | 稀硫酸的浓度为0.1mol/L | |
| C. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3.H2O) | |
| D. | d点所示溶液中:c(NH4+)═2c(SO42-) |
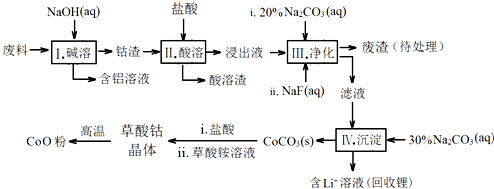
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15.废渣中的成分有LiF,Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$ Co3O4+6CO2.
(6)某锂离子电池的总反应为C+LiCoO2$?_{放电}^{充电}$ LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.
| A. | 7.8 g Na2O2中存在的共价键总数为0.1NA | |
| B. | 2.4g石墨中含有C-C键个数为0.4NA | |
| C. | 标准状况下,22.4LCC14中所含分子数为NA | |
| D. | 0.1 mol氯化铁溶于1L水中,所得溶液中Fe3+的数目为0.1NA |

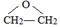 ;
; .
.