题目内容
4.下列有关热化学方程式书写正确的是( )| 已知条件 | 热化学方程式 | |
| A | 中和热为57.3kJ/mol | H2SO4(aq)+Ba(OH)2(aq)═ BaSO4(s)+2H2O(l) △H=-114.6kJ/mol |
| B | 合成氨反应生成0.1mol NH3时放出a kJ热量 | N2(g)+3H2(g)?2NH3(g) △H=-20a kJ/mol |
| C | H2的燃烧热为285.8kJ/mol | H2(g)+$\frac{1}{2}$O2(g)═H2O(g) △H=-285.8kJ/mol |
| D | 碳的燃烧热为393.5kJ/mol | 2C(s)+O2(g)═2CO(g) △H=-787kJ/mol |
| A. | A | B. | B | C. | C | D. | D |
分析 A.生成硫酸钡沉淀也会放出热量;
B.生成0.1mol NH3时放出a kJ热量,则生成2mol氨气放出的热量为20a kJ,注明物质的聚集状态与反应热书写热化学方程式;
C.氢气燃烧热是通常条件下1mol氢气燃烧生成液态水放出的热量;
D.碳的燃烧热是通常条件下1mol碳完全燃烧生成二氧化碳气体放出的热量.
解答 解:A.中和热为57.3kJ/mol,生成硫酸钡沉淀也会放出热量,H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l),△H<-114.6kJ/mol,故A错误;
B.生成0.1mol NH3时放出a kJ热量,则生成2mol氨气放出的热量为20a kJ,热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-20a kJ/mol,故B正确;
C.氢气燃烧热是通常条件下1mol氢气燃烧生成液态水放出的热量,热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol,故C错误;
D.碳的燃烧热是通常条件下1mol碳完全燃烧生成二氧化碳气体放出的热量,热化学方程式为:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,故D错误,
故选:B.
点评 本题考查热化学方程式书写、中和热、燃烧热,难度不大,注意反应热与物质的聚集状态有关、与化学计量数成正比,理解燃烧热概念.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
14.如表为元素周期表的一部分,根据信息,回答下列物问题.
(1)非金属性最强的元素是Na,
(2)CO2中存在的化学键为共价键.
(3)下列判断正确的是B
A、碱性强弱:Mg(OH)2>NaOH B、氢化物稳定性:HF>HCl C、酸性强弱:H3PO4>H2SO4.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | O | F | |||||
| 3 | Na | Mg | P | S | Cl |
(2)CO2中存在的化学键为共价键.
(3)下列判断正确的是B
A、碱性强弱:Mg(OH)2>NaOH B、氢化物稳定性:HF>HCl C、酸性强弱:H3PO4>H2SO4.
15.高锰酸钾制氯气:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O 地康法制氯气:4HCl+O2$\frac{\underline{催化剂}}{△}$ 2Cl2+2H2O 二氧锰制氯气:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O 下列说法正确的是( )
| A. | 实验室常用地康法制氯气 | B. | 氧化性强弱顺序是O2>KMnO4>MnO2 | ||
| C. | 氧化性强弱顺序是KMnO4>O2>MnO2 | D. | 氧化性强弱顺序是KMnO4>MnO2>O2 |
12.下列依据热化学方程式得出的结论不正确的是( )
| A. | H2燃烧热为285.8 kJ•mol-1,则2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| B. | 若C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则0.5mol NaOH固体与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2SO2(g)+O2(g)?2SO2 (g)△H=-196.64 kJ•mol-1,在一定温度下,向一固定体积的密闭容器中通入2mol SO2、1mol O2,达到平衡时放出热量小于196.64 kJ |
9.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含离子的化学组分及其浓度如下表:
根据表中数据判断试样的pH约为4.
(2)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料.
已知:2H2(g)+O2(g)═2H2O(g) K12C(s)+O2(g)=2CO (g) K2
2C(s)+2H2O(g)═2CO(g)+2H2(g)则K=$\sqrt{\frac{{K}_{2}}{{K}_{1}}}$(用含K1、K2的式子表示).
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
A.Ca(OH)2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化,已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料.
已知:2H2(g)+O2(g)═2H2O(g) K12C(s)+O2(g)=2CO (g) K2
2C(s)+2H2O(g)═2CO(g)+2H2(g)则K=$\sqrt{\frac{{K}_{2}}{{K}_{1}}}$(用含K1、K2的式子表示).
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
A.Ca(OH)2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化,已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
16.下列说法正确的是( )
| A. | 2.3gNa投入到97.7g水中形成的溶液溶质质量分数为4% | |
| B. | 25gCuSO4•5H2O溶于75g水之后,溶质的质量分数为16% | |
| C. | 相同质量的Na2O和Na2O2溶于相同体积的足量水中,所得溶液的质量分数相同 | |
| D. | 向含Na2CO310.6g的饱和碳酸钠溶液中通入过量CO2,所得溶液溶质质量为16.8g |
13.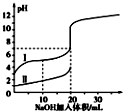 室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )
室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )
 室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )
室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的反应曲线 | |
| B. | pH=7 时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=170 | |
| C. | V(NaOH)=10.00 mL 时,醋酸溶液的导电性更强 | |
| D. | 向盐酸中加 NaOH 至 pH=12 时,V(NaOH)=200/9 mL |
14.下列反应中的氨与反应4NH3+5O2→4NO+6H2O中的氨作用不相同的是( )
| A. | 4NH3+6NO→5N2+6H2O | B. | 2NH3+3CuO→3Cu+N2+3H2O | ||
| C. | 2Na+2NH3→2NaNH2+H2↑ | D. | 4NH3+3O2→4N2+6H2O |