题目内容
立方氮化硼是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一.请回答下列问题:
(1)在第二周期,原子的第一电离能一般随核电荷数的增大而逐渐 ,比较下列原子的第一电离能:Be B,N O(填“>”“<”),其原因是 .
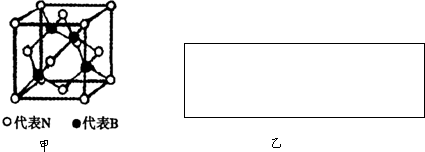
(2)图甲为立方氮化硼的晶胞,则氮化硼的化学式为 ,该晶体中B原子填充N原子的 空隙.
若该晶胞的边长为a cm,那么该晶体的密度为 g/cm3(只要求列出算式).
(3)立方氮化硼的晶体结构与金刚石的结构相似,但其熔点比金刚石的低,试分析其原因 .
(4)立方氮化硼由六方氮化硼在高温高压下制备,六方氮化硼又称“白玉墨”,结构和许多性质与石墨相似,六方氮化硼中N原子的杂化轨道类型为 ,请在图乙的方框中画出六方氮化硼的平面结构示意图(用“○”代表N原子,用“●”代表B原子,每种原子不少于7个).

(1)在第二周期,原子的第一电离能一般随核电荷数的增大而逐渐
(2)图甲为立方氮化硼的晶胞,则氮化硼的化学式为
若该晶胞的边长为a cm,那么该晶体的密度为
(3)立方氮化硼的晶体结构与金刚石的结构相似,但其熔点比金刚石的低,试分析其原因
(4)立方氮化硼由六方氮化硼在高温高压下制备,六方氮化硼又称“白玉墨”,结构和许多性质与石墨相似,六方氮化硼中N原子的杂化轨道类型为
考点:晶胞的计算
专题:化学键与晶体结构
分析:(1)同周期原子的第一电离能一般随核电荷数的增大而呈增大趋势,Be原子中2s轨道处于全充满状态,N原子中2p轨道处于半充满状态,是比较稳定的状态,故它们的第一电离能高于两边相邻的原子;
(2)根据均摊法计算晶胞中N、B原子数目确定化学式;由晶胞结构可知,B原子位于4个N原子形成的四面体的中心位置;根据晶胞含有微粒数目计算晶胞的质量,根据ρ=
计算密度;
(3)都属于原子晶体,根据键长分析,键长越长熔点越低;
(4)六方氮化硼晶体与石墨结构相似,石墨层内为邻近的三个碳原子形成三个共价单键并排列成平面正六边形的网状结构,将正六边形间位位置的3个C原子换成3个B原子即得六方氮化硼的层内平面结构,根据B原子成键判断其杂化方式.
(2)根据均摊法计算晶胞中N、B原子数目确定化学式;由晶胞结构可知,B原子位于4个N原子形成的四面体的中心位置;根据晶胞含有微粒数目计算晶胞的质量,根据ρ=
| m |
| V |
(3)都属于原子晶体,根据键长分析,键长越长熔点越低;
(4)六方氮化硼晶体与石墨结构相似,石墨层内为邻近的三个碳原子形成三个共价单键并排列成平面正六边形的网状结构,将正六边形间位位置的3个C原子换成3个B原子即得六方氮化硼的层内平面结构,根据B原子成键判断其杂化方式.
解答:
解:(1)同周期原子的第一电离能一般随核电荷数的增大而呈增大趋势,Be原子中2s轨道处于全充满状态,N原子中2p轨道处于半充满状态,是比较稳定的状态,故它们的第一电离能高于两边相邻的原子,故第一电离能Be>B、N>O,
故答案为:增大;>;>;Be原子中2s轨道处于全充满状态,N原子中2p轨道处于半充满状态,是比较稳定的状态,故它们的第一电离能高于两边相邻的原子;
(2)晶胞中N原子数目=8×
+6×
=4、B原子数目=4,故氮化硼的化学式为BN;由晶胞结构可知,B原子位于4个N原子形成的四面体的中心位置,故B原子填充N原子的正四面体空隙;晶胞的质量=
,晶胞的体积为a3cm3,根据晶胞密度ρ=
=
=
g/cm3,
故答案为:BN;四面体;
g/cm3;
(3)都属于原子晶体,立方氮化硼晶体中氮硼键的键长比金刚石晶体中碳碳键的键长要长,故熔点比金刚石的低,
故答案为:立方氮化硼晶体中氮硼键的键长比金刚石晶体中碳碳键的键长要长,故熔点比金刚石的低;
(4)六方氮化硼晶体与石墨结构相似,石墨层内为邻近的三个碳原子形成三个共价单键并排列成平面正六边形的网状结构,将正六边形间位位置的3个C原子换成3个B原子即得六方氮化硼的层内平面结构,B原子成3个B-C键、变化孤对电子,故B原子采取sp2杂化,六方氮化硼的平面结构示意图为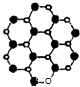 ,
,
故答案为:sp2; .
.
故答案为:增大;>;>;Be原子中2s轨道处于全充满状态,N原子中2p轨道处于半充满状态,是比较稳定的状态,故它们的第一电离能高于两边相邻的原子;
(2)晶胞中N原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4×25g |
| NA |
| m |
| V |
| ||
| a3 cm3 |
| 100 |
| a3×NA |
故答案为:BN;四面体;
| 100 |
| a3×NA |
(3)都属于原子晶体,立方氮化硼晶体中氮硼键的键长比金刚石晶体中碳碳键的键长要长,故熔点比金刚石的低,
故答案为:立方氮化硼晶体中氮硼键的键长比金刚石晶体中碳碳键的键长要长,故熔点比金刚石的低;
(4)六方氮化硼晶体与石墨结构相似,石墨层内为邻近的三个碳原子形成三个共价单键并排列成平面正六边形的网状结构,将正六边形间位位置的3个C原子换成3个B原子即得六方氮化硼的层内平面结构,B原子成3个B-C键、变化孤对电子,故B原子采取sp2杂化,六方氮化硼的平面结构示意图为
 ,
,故答案为:sp2;
 .
.
点评:本题考查电离能、晶胞结构与计算、熔沸点比较、杂化轨道等,难度中等,(4)画图为易错点、难点,掌握识记中学常见晶胞结构.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
下列用来表示物质变化的反应式中,错误的是( )
| A、钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- |
| B、向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+H++Ba2++OH-═BaSO4↓+H2O |
| C、明矾水解的离子方程式:Al3++3H2O?Al(OH)3+3H+ |
| D、K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
下列各溶液中,微粒的物质的量浓度关系不正确的是( )
| A、c(NH4+)相等的(NH4)2SO4溶液和(NH4)2CO3溶液 c[(NH4)2SO4]<[(NH4)2CO3] |
| B、0.1mol/L的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| C、0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| D、10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合 c(Cl-)>c(Na+)>c(OH-)>c(H+) |
下列各组离子在溶液中能够大量共存,当溶液中的pH=1时,有气体产生;而当溶液中的pH=13时,又能生成沉淀.则该组离子可能是( )
A、Na+、K+、Al
| ||||
B、Fe2+、Na+、S
| ||||
C、Mg2+、N
| ||||
D、Ba2+、K+、Cl-、Mn
|


