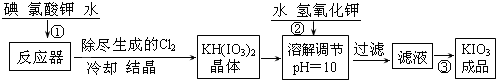
题目内容
3.氯水是实验室常需临时配制的一种试剂.图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实脸小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓人空气的仪器).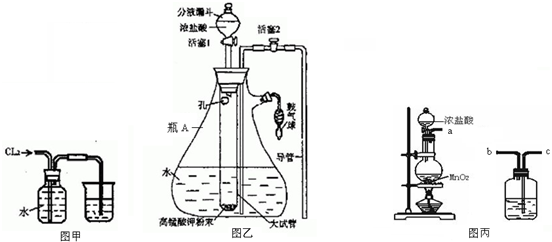
(1)氯水需临时配制的原因是:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑(用化学方程式表示).
(2)图甲所示装置中,烧杯内的液体是氢氧化钠溶液,作用是吸收过量的氯气.
(3)图甲装置中的氯气可以用图丙中的发生装置制备,写出圆底烧瓶中发生反应的化学方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.若想制得纯净干燥的氯气可用图丙中的装置完成实验,装置的连接顺序是acbcb(装置可重复使用).
(4)安照上面的连接顺序在广口瓶中的试剂与作用分别是饱和食盐水,除去氯化氢;浓硫酸,除去水蒸气(按先后顺序填写).
图乙所示装置中,瓶A 内的大试管上端管壁钻有一个小孔,用图乙所示装置中配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注人大试管内.
②关闭活塞1,盖上分液漏斗上口玻璃塞.浓盐酸和大试管内的高锰酸钾粉末反应产生氯气.
③轻轻摇动瓶A,使氯气不断溶入水中.
(5)用图乙装置能在较短时间内得到饱和氯水,除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是氯气在瓶内产生较大的压强,增大了氯气的溶解度.分液漏斗中的盐酸应分数次加人试管内.若一次加人太多的盐酸,可能引起的后果是在瓶内产生过多的氯气,瓶内压强过大会使瓶A的橡皮塞弹开.
(6)配制氯水完成后,不必拆卸装置即可从瓶A 中取用少量氯水,方法是打开活塞2,关闭活塞1,用鼓气球向瓶A中鼓入空气.
分析 (1)氯水中的次氯酸不稳定易分解为盐酸和氧气;
(2)氯气有毒,直接排放能引起空气污染,可以和强碱反应,用碱液吸收;
(3)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气;制取的氯气中含有水蒸气,氯化氢,先通过盛有饱和食盐水的洗气瓶除去氯化氢,再通过盛有浓硫酸的洗气瓶除去水;
(4)制取的氯气中含有水蒸气,氯化氢,先通过盛有饱和食盐水的洗气瓶除去氯化氢,再通过盛有浓硫酸的洗气瓶除去水;
(5)增大压强可以增大氯气的溶解度;一次加入太多的盐酸会使得产生的氯气的量多,出现很大的压强;
(6)根据大气压强原理来寻找排出液体的方法.
解答 解:(1)氯水中的次氯酸不稳定易分解为盐酸和氧气,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,所以氯水久置会因为次氯酸分解而失效,
故答案为:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
(2)氯气有毒,多余的氯气不排放到空气中去,氯气可以和强碱氢氧化钠反应来吸收氯气,
故答案为:氢氧化钠溶液;吸收过量的氯气;
(3)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气,方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;制取的氯气中含有水蒸气,氯化氢,先通过盛有饱和食盐水的洗气瓶除去氯化氢,再通过盛有浓硫酸的洗气瓶除去水,洗气时应长进短出,所以正确的顺序为:acbcb;
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;acbcb;
(4)制取的氯气中含有水蒸气,氯化氢,先通过盛有饱和食盐水的洗气瓶除去氯化氢,再通过盛有浓硫酸的洗气瓶除去水;
故答案为:饱和食盐水,除去氯化氢;浓硫酸,除去水蒸气;
(5)图乙装置能在较短时间内得到饱和氯水,除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是氯气在瓶内产生较大的压强,增大了氯气的溶解度,分液漏斗中的盐酸应分数次加入试管内,若一次加入太多的盐酸,和高锰酸钾反应产生的氯气量太多,会导致瓶内压强过大会使瓶A的橡皮塞弹开,
故答案为:氯气在瓶内产生较大的压强,增大了氯气的溶解度;在瓶内产生过多的氯气,瓶内压强过大会使瓶A的橡皮塞弹开.
(6)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,打开活塞2,关闭活塞1,用鼓气球向瓶A中鼓入空气,瓶内压强增大,会将液体从A瓶中排出,
故答案为:打开活塞2,关闭活塞1,用鼓气球向瓶A中鼓入空气.
点评 本题考查了氯气的实验室制备,明确氯气性质以及制取原理是解题关键,属于综合知识的考查,难度大.

| A. | 标准状况下,1LC2H5OH燃烧后生成的CO2分子数约为$\frac{{N}_{A}}{11.2}$ | |
| B. | 电解食盐水水时,当产生22.4LH2时,电路中转移的电子数为2NA | |
| C. | 标准状况下,11.2LCH4和C2H4混合气体中含有碳原子的数目为2NA | |
| D. | NH3易溶于水,3.4gNH3溶于1LH2O,溶液中氮原子总数为0.6NA |