题目内容
6.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)═NH3(g)+HI(g);②2HI(g)═H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L-1,c(HI)=5mol•L-1,则此温度下反应①的平衡常数为( )
| A. | 36 | B. | 30 | C. | 25 | D. | 20 |
分析 反应①的平衡常数k=c(NH3)•c(HI),NH4I分解生成的HI为平衡时HI与分解的HI之和,即为NH4I分解生成的NH3,由反应②可知分解的c(HI)为平衡时c(H2)的2倍,求出为NH4I分解生成的NH3,代入反应①的平衡常数k=c(NH3)•c(HI)计算.
解答 解:平衡时c(HI)=3mol•L-1,HI分解生成的H2的浓度为0.5mol•L-1.
2HI(g)═H2(g)+I2(g)
初始浓度:6mol•L-1 00
分解的浓度:1mol•L-1 0.5mol•L-1 0.5mol•L-1
平衡时浓度:5mol•L-1 0.5mol•L-1 0.5mol•L-1
NH4I分解生成的HI的浓度为6mol•L-1,所以NH4I分解生成的NH3的浓度为6mol•L-1,
所以反应①的平衡常数k=c(NH3)•c(HI)=6mol•L-1×5mol•L-1=30mol2•L-2.
故选B.
点评 本题考查了化学平衡的有关计算,题目难度中等,注意把握三段式在化学平衡计算中的应用方法以及平衡常数的表达式和计算,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
15.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1LC2H5OH燃烧后生成的CO2分子数约为$\frac{{N}_{A}}{11.2}$ | |
| B. | 电解食盐水水时,当产生22.4LH2时,电路中转移的电子数为2NA | |
| C. | 标准状况下,11.2LCH4和C2H4混合气体中含有碳原子的数目为2NA | |
| D. | NH3易溶于水,3.4gNH3溶于1LH2O,溶液中氮原子总数为0.6NA |
16.KMnO4能将草酸(H2C2O4)氧化.在25℃下,某同学欲通过对比实验探究初始pH和草酸浓度对该反应速率的影响.完成实验设计表,表中不要留空格.
(2)某同学欲利用高锰酸钾法测定碳酸钙样品中钙的含量.过程如下:
步骤Ⅰ称取2.50g碳酸钙试样,溶解于稀盐酸,以CaC2O4形式沉淀钙.
沉淀Ⅱ将沉淀过滤洗涤,溶于稀硫酸后定容在250mL容量瓶中.
步骤Ⅲ每次取20.00mL溶液,用0.020mol/L KMnO4标准溶液滴定,三次滴定消耗标准液的平均体积为36.42mL.
①滴定过程中用到的玻璃仪器有酸式滴定管、锥形瓶,滴定终点的现象是加入最后一滴KMnO4溶液,溶液变为浅红色,浅红色30s内不褪去,说明滴定到终点.
②步骤Ⅱ中若将沉淀溶于稀盐酸,会使测定结果偏高(填“偏高”“偏低”或“无影响”).
③试样中钙的质量分数是91.05%.
 | 初始pH | V(KMnO4)/mL | V(H2C2O4)/mL | V(H2O)/mL |
| ① | 4 | 20 | 10 | |
| ② | 5 | 10 | 5 | |
| ③ | 20 | 10 |
步骤Ⅰ称取2.50g碳酸钙试样,溶解于稀盐酸,以CaC2O4形式沉淀钙.
沉淀Ⅱ将沉淀过滤洗涤,溶于稀硫酸后定容在250mL容量瓶中.
步骤Ⅲ每次取20.00mL溶液,用0.020mol/L KMnO4标准溶液滴定,三次滴定消耗标准液的平均体积为36.42mL.
①滴定过程中用到的玻璃仪器有酸式滴定管、锥形瓶,滴定终点的现象是加入最后一滴KMnO4溶液,溶液变为浅红色,浅红色30s内不褪去,说明滴定到终点.
②步骤Ⅱ中若将沉淀溶于稀盐酸,会使测定结果偏高(填“偏高”“偏低”或“无影响”).
③试样中钙的质量分数是91.05%.
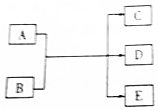 一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体.
一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体. ,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.
,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.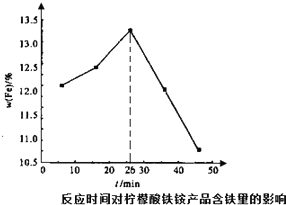 柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下: