题目内容
1.类比法是化学学习过程中一种重要方法,以下类比关系正确的是( )| A. | 工业上可以电解熔融的氯化镁或氯化铝制得相应的金属单质 | |
| B. | Cl2、Br2、I2都具有强氧化性,都能将铁氧化成+3价的铁盐 | |
| C. | 二氧化碳和二氧化硫都是氧化物,两者都不能和氯化钙溶液反应 | |
| D. | 氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水 |
分析 A.氯化铝是分子晶体,熔融状态下以分子存在;
B.碘单质氧化性较弱,碘能氧化Fe生成+2价亚铁盐;
C.二氧化硫和二氧化碳都是酸性氧化物,其水溶液都呈弱酸性,酸性都小于盐酸;
D.FeO具有还原性,能被强氧化剂氧化生成+3价铁离子.
解答 解:AlCl3是分子晶体,熔融状态下以分子存在,所以熔融状态下不导电,应该采用电解熔融Al2O3的方法冶炼Al,故A错误;
B.碘单质氧化性较弱,碘能氧化Fe生成+2价亚铁盐,且I-能被铁离子氧化生成I2,故B错误;
C.SO2和CO2都是酸性氧化物,其水溶液都呈弱酸性,酸性都小于盐酸,根据强酸制取弱酸知,两者都不能和CaCl2溶液反应,故C正确;
D.FeO具有还原性,能被强氧化剂氧化生成+3价铁离子,硝酸具有强氧化性和酸性,能和FeO反应生成Fe(NO3)3而不是Fe(NO3)2,故D错误;
故选C.
点评 本题考查探究化学规律,为高频考点,侧重考查化学规律中的反常现象,明确元素化合物性质及化学反应原理是解本题关键,易错选项是D,会正确书写D中离子方程式,题目难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
9.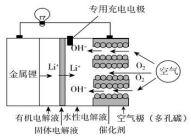 锂空气电池比锂离子电池具有更高的能量密度,前景非常广阔,其结构及工作原理如图(固体电解液只允许Li+通过),下列有关说法不正确的是( )
锂空气电池比锂离子电池具有更高的能量密度,前景非常广阔,其结构及工作原理如图(固体电解液只允许Li+通过),下列有关说法不正确的是( )
 锂空气电池比锂离子电池具有更高的能量密度,前景非常广阔,其结构及工作原理如图(固体电解液只允许Li+通过),下列有关说法不正确的是( )
锂空气电池比锂离子电池具有更高的能量密度,前景非常广阔,其结构及工作原理如图(固体电解液只允许Li+通过),下列有关说法不正确的是( )| A. | 电池工作时,正极反应式:O2+2H2O+4e-=4OH- | |
| B. | 去掉固体电解液和有机电解质,电池反应发生改变 | |
| C. | 充电时,生成14 g Li,空气极质量增加16 g | |
| D. | 充电时,专用充电电极可以有效防止空气极腐蚀和劣化 |
16.KMnO4能将草酸(H2C2O4)氧化.在25℃下,某同学欲通过对比实验探究初始pH和草酸浓度对该反应速率的影响.完成实验设计表,表中不要留空格.
(2)某同学欲利用高锰酸钾法测定碳酸钙样品中钙的含量.过程如下:
步骤Ⅰ称取2.50g碳酸钙试样,溶解于稀盐酸,以CaC2O4形式沉淀钙.
沉淀Ⅱ将沉淀过滤洗涤,溶于稀硫酸后定容在250mL容量瓶中.
步骤Ⅲ每次取20.00mL溶液,用0.020mol/L KMnO4标准溶液滴定,三次滴定消耗标准液的平均体积为36.42mL.
①滴定过程中用到的玻璃仪器有酸式滴定管、锥形瓶,滴定终点的现象是加入最后一滴KMnO4溶液,溶液变为浅红色,浅红色30s内不褪去,说明滴定到终点.
②步骤Ⅱ中若将沉淀溶于稀盐酸,会使测定结果偏高(填“偏高”“偏低”或“无影响”).
③试样中钙的质量分数是91.05%.
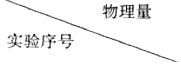 | 初始pH | V(KMnO4)/mL | V(H2C2O4)/mL | V(H2O)/mL |
| ① | 4 | 20 | 10 | |
| ② | 5 | 10 | 5 | |
| ③ | 20 | 10 |
步骤Ⅰ称取2.50g碳酸钙试样,溶解于稀盐酸,以CaC2O4形式沉淀钙.
沉淀Ⅱ将沉淀过滤洗涤,溶于稀硫酸后定容在250mL容量瓶中.
步骤Ⅲ每次取20.00mL溶液,用0.020mol/L KMnO4标准溶液滴定,三次滴定消耗标准液的平均体积为36.42mL.
①滴定过程中用到的玻璃仪器有酸式滴定管、锥形瓶,滴定终点的现象是加入最后一滴KMnO4溶液,溶液变为浅红色,浅红色30s内不褪去,说明滴定到终点.
②步骤Ⅱ中若将沉淀溶于稀盐酸,会使测定结果偏高(填“偏高”“偏低”或“无影响”).
③试样中钙的质量分数是91.05%.

 硫酸工业的生产工艺流程可简略表示如下:
硫酸工业的生产工艺流程可简略表示如下: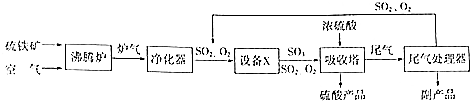 请回答下列问题:
请回答下列问题: