题目内容
4.照相底片的感光材料上含有一层AgBr胶体粒子的明胶,照相感光过程中,在光的作用下,AgBr分解成“银核”AgBr→Ag+Br 显影时,感光材料经过显影液作用,含有银核的AgBr粒子被还原为金属银,成为黑色成像,而大量未感光的AgBr粒子在定影时,与定影液中的硫代硫酸钠(Na2S2O3)反应形成[Ag(S2O3)2]3-络离子而溶解于定影液中:Ag++2S2O32-=[Ag(S2O3)2]3-本实验采用简单的化学沉淀方法从废定影液中回收银的方法.其原理是在废定影液中加入硫化钠与定影液中的络离子中的银转化为Ag2S沉淀,并使定影液再生,;再将硫化银送至高温炉灼烧,硫化银就分解为单质银和二氧化硫气体,就达到回收银的目的.
(1)写出Na2S与Na3[Ag(S2O3)2]反应的化学方程式Na2S+2Na3[Ag(S2O3)2]=Ag2S↓+4Na2S2O3.
(2)如果废定影液中含银量为5.68g.L-1,试计算2升废定影液中至少加入Na2S的物质的量是0.0526mol.(保留小数点后四位数)
分析 (1)Na2S与Na3[Ag(S2O3)2]发生的是复分解反应;
(2)求出2L废定影液中含有的银的物质的量,然后根据2molAg~2molNa3[Ag(S2O3)2]~1molNa2S来计算.
解答 解:(1)Na2S与Na3[Ag(S2O3)2]发生的是复分解反应,除了生成Ag2S沉淀还生成Na2S2O3,化学方程式为:Na2S+2Na3[Ag(S2O3)2]=Ag2S↓+4Na2S2O3;故答案为:Na2S+2Na3[Ag(S2O3)2]=Ag2S↓+4Na2S2O3;
(2)2L废定影液中含有的银的质量为m=5.68g/L×2L=11.36g,物质的量n=$\frac{11.36g}{108g/mol}$=0.1052mol,设Na2S的物质的量为xmol,根据2molAg~2molNa3[Ag(S2O3)2]~1molNa2S可有:
2molAg~2molNa3[Ag(S2O3)2]~1molNa2S
2 1
0.1052mol xmol
则有:$\frac{2}{0.1052mol}=\frac{1}{xmol}$
解得x=0.0526mol
故答案为:0.0526mol.
点评 本题依托滴定的有关知识,迁移考查了化学方程式的书写和有关计算,理清反应原理是解题关键,难度不大.

练习册系列答案
相关题目
15.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:ANa2CO3 BBa(OH)2 DAgNO3
(2)E溶液呈酸性的原因是:(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+
(3 ) 将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+).
(4 )在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:ANa2CO3 BBa(OH)2 DAgNO3
(2)E溶液呈酸性的原因是:(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+
(3 ) 将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+).
(4 )在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.
13.下列各组气体制备的发生装置相同的是( )
| A. | O2、H2 | B. | Cl2、HCl | C. | H2、Cl2 | D. | O2、HCl |
14.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)?NH3(g)+HI(g);②2HI(g)?H2(g)+I2(g);③2NH3(g)?N2(g)+3H2(g).
达到平衡时,c(H2)=2mol/L,c(N2)=0.5mol/L,c(HI)=4mol/L,则平衡时 NH3的浓度为( )
①NH4I(s)?NH3(g)+HI(g);②2HI(g)?H2(g)+I2(g);③2NH3(g)?N2(g)+3H2(g).
达到平衡时,c(H2)=2mol/L,c(N2)=0.5mol/L,c(HI)=4mol/L,则平衡时 NH3的浓度为( )
| A. | 0.5 mol•L-1 | B. | 2 mol•L-1 | C. | 4 mol•L-1 | D. | 5 mol•L-1 |
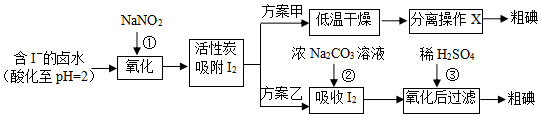
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.