题目内容
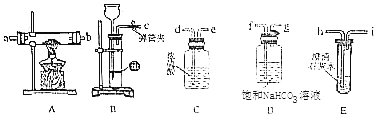
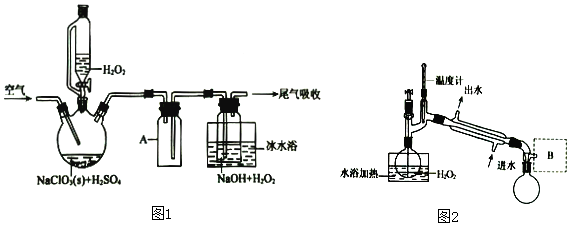
18.ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法制备NaClO2固体的实验装置如图1所示.已知:2NaClO3+H2O2+H2SO4═2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
请回答:
(1)仪器A的作用是防止倒吸;冰水浴冷却的目的是降低NaClO2的溶解度、减少H2O2的分解、增加ClO2的溶解度、减少ClO2的分解(写两种).
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;空气流速过快时,ClO2不能被充分吸收
(3)Clˉ存在时会催化ClO2的生成.反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气.该过程可能经两步完成,请将其补充完整:①2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O(用离子方程式表示),②H2O2+Cl2═2Cl-+O2+2H+.
(4)H2O2浓度对反应速率有影响.通过图2所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备.该设备的作用是减压,馏出物是H2O.
(5)抽滤法分离NaClO2过程中,下列操作不正确的是C
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管,关闭水龙头.
分析 氯酸钠(NaClO3)在酸性条件下与过氧化氢生二氧化氯,ClO2与氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O,
(1)仪器A为安全瓶,冰水浴降低NaClO2的溶解度;减少H2O2的分解;增加ClO2的溶解度;减少ClO2的分解;
(2)空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;空气流速过快时,ClO2不能被充分吸收;
(3)Clˉ存在时会催化ClO2的生成,反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气,则氯离子与氯酸根离子反应生成ClO2和氯气,据此分析;
(4)过氧化氢受热易分解,故采用减压蒸馏的方式;
(5)抽滤法分离NaClO2过程中,洗涤时为洗净晶体,应让洗涤剂缓慢通过滤纸,让洗涤剂和晶体充分接触.
解答 解:(1)仪器A为安全瓶,防止倒吸;冰水浴冷却的目的是为降低NaClO2的溶解度;减少H2O2的分解;增加ClO2的溶解度;减少ClO2的分解用冰水浴冷却;
故答案为:防止倒吸;降低NaClO2的溶解度、减少H2O2的分解、增加ClO2的溶解度、减少ClO2的分解;
(2)空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;空气流速过快时,ClO2不能被充分吸收,则空气流速过快或过慢,均降低NaClO2产率;
故答案为:空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;空气流速过快时,ClO2不能被充分吸收;
(3)Clˉ存在时会催化ClO2的生成,反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气反应为,2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O,H2O2+Cl2═2Cl-+O2+2H+;
故答案为:2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O;
(4)过氧化氢受热易分解,故采用减压蒸馏的方式,则B处增加一个减压设备,馏出物为H2O;
故答案为:减压;H2O;
(5)抽滤法分离NaClO2过程中,洗涤时为洗净晶体,应让洗涤剂缓慢通过滤纸,让洗涤剂和晶体充分接触;
故答案为:C.
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、实验方案设计、信息获取与迁移运用等,需要学生具备扎实的基础,题目难度中等.

| A. | 铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液和盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | CaCO3跟稀硫酸反应:CaCO3+H++SO42-═CaSO4+H2O+CO2↑ | |
| D. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O |
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L)中,在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)(Ⅰ)
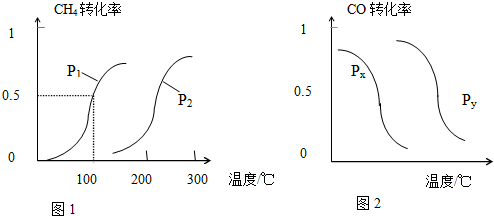
CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol•L-1•min-1.
②图中的p1<p2(填“<”、“>”或“=”),100℃时的平衡常数为2.25×10-4.
③该反应的△H>0,△S>0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)?CH3OH△H<0 (Ⅱ)
①若容器的容积不变,下列措施可增大甲醇产率的是ABD(填序号).
A.降低温度
B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大
D.再充入a mol CO和3a mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 180 | $\frac{2}{3}$ | 0.1 |
| 2 | n | $\frac{2}{3}$ | 5 |
| 3 | 350 | m | 5 |
b.根据反应Ⅱ的特点,如图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线,请指明图2中的压强px=0.2MPa.
| 糖类 | 油脂 | 蛋白质 | 其他 | |
| 花生米 | 24% | 39% | 26% | 11% |
| 小麦 | 76% | 2% | 11% | 11% |
(1)比较500g小麦和500g花生米的能量大小.(假设能量能被完全释放)
(2)我们平时所吃的植物油之一就是花生油.将花生米加工后用机器压榨,约有85%的油脂可成为商品花生油.某食品厂购买了100吨花生米,他们可生产多少吨商品花生油?