题目内容
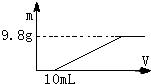 过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5mol?L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为( )
过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5mol?L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为( )| A、0.05mol |
| B、0.1mol |
| C、0.2mol |
| D、0.25mol |
考点:化学方程式的有关计算
专题:计算题
分析:由图可知,开始加入10mLNaOH溶液没有沉淀生成,说明Cu与硝酸反应中硝酸过量,沉淀量最大时,溶液中溶质注意NaNO3,根据中和硝酸消耗的NaOH体积,计算剩余n(HNO3),根据n=
计算6.4gCu的物质的量,根据Cu元素守恒计算反应得到n[Cu(NO3)2],根据硝酸根守恒可知,反应后的溶液中n(NO3-)=n剩余(HNO3)+2n[Cu(NO3)2],据此解答.
| m |
| M |
解答:
解:由图可知,开始加入10mLNaOH溶液没有沉淀生成,说明Cu与硝酸反应中硝酸过量,故剩余n(HNO3)=0.01L×5mol/L=0.05mol,沉淀量最大时,溶液中溶质注意NaNO3,
6.4gCu的物质的量=
=0.1mol,根据Cu元素守恒可知,反应得到n[Cu(NO3)2]=n(Cu)=0.1mol,
根据硝酸根守恒可知,反应后的溶液中n(NO3-)=n剩余(HNO3)+2n[Cu(NO3)2]=0.05mol+0.1mol×2=0.25mol,
故选D.
6.4gCu的物质的量=
| 6.4g |
| 64g/mol |
根据硝酸根守恒可知,反应后的溶液中n(NO3-)=n剩余(HNO3)+2n[Cu(NO3)2]=0.05mol+0.1mol×2=0.25mol,
故选D.
点评:本题以图象形式可知混合物计算,根据图象分析反应的反应是关键,注意利用守恒思想进行解答,难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列对应化学反应的离子方程式正确的是( )
A、MnO2与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| B、KHSO3的水解:HSO3-+H2O?SO32-+H3O+ | ||||
| C、Na2O2与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ | ||||
| D、少量Ca(HCO3)2溶液与足量的NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
下列各组中的离子,能在溶液中大量共存的是( )
| A、H+、Na+、CO32- |
| B、Ba2+、Na+、SO42- |
| C、K+、H+、OH- |
| D、Ag+、NO3-、H+ |
用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、1 molNa与足量氧气反应转移电子数一定为NA |
| B、标准状况下,22.4 LCHCl3中含有的分子数为NA |
| C、1mol?L-1Na2CO3溶液中含有2NA个Na+ |
| D、常温常压下,71g37Cl2含有NA个37Cl2分子 |
下列离子方程式不正确的是( )
| A、将一小粒金属钠放入水中:2Na+2H2O═2Na++2OH-+H2↑ |
| B、将氯气通入氢氧化钠溶液中:Cl2+2OH-═C1-+C1O-+H2O |
| C、向CuSO4溶液中加入适量Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ |
| D、向稀硝酸中加人铜片:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
下列各組离子在指定的溶液中一定能大量共存的是( )
| A、c(H)/c(OH-)=1012的溶液中:Fe2+、Al3+、NO3-、Cl- |
| B、由水电离出的c (OH-)=10-13mol?L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| C、含大量Al3+的溶液中:K+、Na+、SO32-、ClO- |
| D、无色溶液中:K+、Na+、MnO4-、SO42- |