题目内容
下列各組离子在指定的溶液中一定能大量共存的是( )
| A、c(H)/c(OH-)=1012的溶液中:Fe2+、Al3+、NO3-、Cl- |
| B、由水电离出的c (OH-)=10-13mol?L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| C、含大量Al3+的溶液中:K+、Na+、SO32-、ClO- |
| D、无色溶液中:K+、Na+、MnO4-、SO42- |
考点:离子共存问题
专题:离子反应专题
分析:A.c(H+)/c(OH-)=1012的溶液c(H+)>c(OH-),溶液呈酸性;
B.由水电离出的c (OH-)=10-13mol?L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性;
C.与Al3+发生反应的离子不能大量共存;
D.有颜色的离子不能大量共存.
B.由水电离出的c (OH-)=10-13mol?L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性;
C.与Al3+发生反应的离子不能大量共存;
D.有颜色的离子不能大量共存.
解答:
解:A.c(H+)/c(OH-)=1012的溶液c(H+)>c(OH-),溶液呈酸性,酸性条件下,Fe2+与NO3-发生氧化还原反应而不能大量共存,故A错误;
B.由水电离出的c (OH-)=10-13mol?L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,无论溶液呈酸性还是碱性,离子之间都不发生任何反应,可大量共存,故B正确;
C.ClO-与Al3+发生互促水解,且与SO32-发生氧化还原反应,不能大量共存,故C错误;
D.无色溶液中,有颜色的MnO4-不能大量共存,故D错误.
故选B.
B.由水电离出的c (OH-)=10-13mol?L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,无论溶液呈酸性还是碱性,离子之间都不发生任何反应,可大量共存,故B正确;
C.ClO-与Al3+发生互促水解,且与SO32-发生氧化还原反应,不能大量共存,故C错误;
D.无色溶液中,有颜色的MnO4-不能大量共存,故D错误.
故选B.
点评:本题考查离子共存问题,侧重于学生的分析能力的考查,为高考常见题型,注意把握题给信息,学习中注意常见离子的性质以及反应类型的判断,注重相关基础知识的积累,难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
下列各组离子能够大量共存的是( )
| A、pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B、使pH试纸显蓝色的溶液中:Cu2+、Fe3+、NO3-、SO42- |
| C、滴入甲基橙指示剂呈红色的溶液中:Na+、NH4+、CO32-、NO3- |
| D、水电离出的c(H+)=1×10-13mol?L-1的溶液中:K+、HCO3-、Cl-、NH4+ |
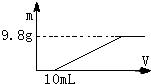 过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5mol?L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为( )
过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5mol?L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为( )| A、0.05mol |
| B、0.1mol |
| C、0.2mol |
| D、0.25mol |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、0.2NA个氢分子的体积为4.48L |
| B、常温常压下,5.85g NaCl中含有0.1NA个分子 |
| C、200mL 1mol?L-1的Fe2(SO4)3溶液中Fe3+数小于0.4NA |
| D、1mol Cl2与足量NaOH溶液充分反应,转移的电子数为2NA |
下列离子方程式书写错误的是( )
| A、向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+H++Ba2++OH-=BaSO4↓+H2O |
| B、少量小苏打溶液滴入Ba(OH)2溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C、碳酸氢根离子发生电离:HCO3-+H2O?H3O++CO32- |
| D、将1mol?L-1 NaAlO2溶液和1.5mol?L-1 HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
 已知难溶性物质K2SO4?MgSO4?2CaSO4在水中存在如下平衡:
已知难溶性物质K2SO4?MgSO4?2CaSO4在水中存在如下平衡:K2SO4?MgSO4?2CaSO4(s)?2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
| A、向该体系中加入饱和NaOH溶液,溶解平衡向右移动 |
| B、向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 |
| C、升高温度,反应速率增大,平衡向正反应方向移动 |
| D、该平衡的Ksp=c(Ca2+)?c(K+)?c(Mg2+)?c(SO42-) |
 右图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,E、G在常温常压下是气体.
右图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,E、G在常温常压下是气体.


