题目内容
A、B、C、D四种短周期元素,原子序数依次增大,A、D同主族,A、B的最外层电子数之和与C的最外层电子数相等,A与B、C分别能形成电子总数相等的分子,且A与C能形成常温下最为常见的液态化合物X.A、B两元素组成的化合物Y常温下为液态,其相对分子质量为32,是常用的火箭推进剂.
请回答下列问题:
(1)C元素的名称 .
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为: .
(3)A、B、C三种元素形成一种盐,其水溶液呈酸性的原因是(用离子方程式表示) .
(4)1g Y在氧气中完全燃烧恢复至常温放出QkJ热量,写出Y在氧气中完全燃烧的热化学方程式: .
请回答下列问题:
(1)C元素的名称
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为:
(3)A、B、C三种元素形成一种盐,其水溶液呈酸性的原因是(用离子方程式表示)
(4)1g Y在氧气中完全燃烧恢复至常温放出QkJ热量,写出Y在氧气中完全燃烧的热化学方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种短周期元素,原子序数依次增大,A与C能形成常温下最为常见的液态化合物X,则A为氢元素、C为氧元素、X为H2O,A、D同主族,D的原子序数大于氧元素,故D为Na;A、B的最外层电子数之和与C的最外层电子数相等,则B的最外层电子数=6-1=5,原子序数小于氧元素,则B为N元素;A与B、C分别能形成电子总数相等的分子,A、B两元素组成的化合物Y常温下为液态,其相对分子质量为32,是常用的火箭推进剂,则Y为N2H4,据此解答.
解答:
解:A、B、C、D四种短周期元素,原子序数依次增大,A与C能形成常温下最为常见的液态化合物X,则A为氢元素、C为氧元素、X为H2O,A、D同主族,D的原子序数大于氧元素,故D为Na;A、B的最外层电子数之和与C的最外层电子数相等,则B的最外层电子数=6-1=5,原子序数小于氧元素,则B为N元素;A与B、C分别能形成电子总数相等的分子,A、B两元素组成的化合物Y常温下为液态,其相对分子质量为32,是常用的火箭推进剂,则Y为N2H4,
(1)由上述分析可知,C为氧元素,故答案为:氧;
(2)H、O、Na三种元素组成的一种常见化合物,是重要的工业产品,该化合物为NaOH,由浓硫酸与氢氧根离子构成,氢氧根离子中O原子与H原子之间形成1对共用电子对,该化合物电子式为: ,故答案为:
,故答案为: ;
;
(3)H、N、O三种元素形成一种盐为NH4NO3,溶液中NH4+水解:NH4++H2O?NH3.H2O+H+,破坏水的电离平衡,溶液呈酸性,
故答案为:NH4++H2O?NH3.H2O+H+;
(4)1gN2H4在氧气中完全燃烧恢复至常温放出QkJ热量,则1molN2H4反应放出的热量=QkJ×
=32QkJ,故N2H4在氧气中完全燃烧的热化学方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-32kJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-32kJ/mol.
(1)由上述分析可知,C为氧元素,故答案为:氧;
(2)H、O、Na三种元素组成的一种常见化合物,是重要的工业产品,该化合物为NaOH,由浓硫酸与氢氧根离子构成,氢氧根离子中O原子与H原子之间形成1对共用电子对,该化合物电子式为:
 ,故答案为:
,故答案为: ;
;(3)H、N、O三种元素形成一种盐为NH4NO3,溶液中NH4+水解:NH4++H2O?NH3.H2O+H+,破坏水的电离平衡,溶液呈酸性,
故答案为:NH4++H2O?NH3.H2O+H+;
(4)1gN2H4在氧气中完全燃烧恢复至常温放出QkJ热量,则1molN2H4反应放出的热量=QkJ×
| 1mol×32g/mol |
| 1g |
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-32kJ/mol.
点评:本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意电子式与热化学方程式的书写.

练习册系列答案
相关题目
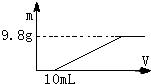 过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5mol?L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为( )
过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5mol?L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为( )| A、0.05mol |
| B、0.1mol |
| C、0.2mol |
| D、0.25mol |
下列离子方程式书写错误的是( )
| A、向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+H++Ba2++OH-=BaSO4↓+H2O |
| B、少量小苏打溶液滴入Ba(OH)2溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C、碳酸氢根离子发生电离:HCO3-+H2O?H3O++CO32- |
| D、将1mol?L-1 NaAlO2溶液和1.5mol?L-1 HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
下列叙述正确的是( )
| A、在pH=1的溶液中,Cu2+、Fe2+、NO3-和SO42-能大量共存 |
| B、用惰性电极电解饱和氯化钠溶液的离子方程式:2Cl-+2H+=H2↑+Cl2↑ |
| C、镁铝合金被碱液腐蚀时,负极反应式为:Mg-2e-=Mg2+ |
| D、检验某未知溶液中是否含SO42-时,应先加盐酸酸化,再加BaCl2溶液 |



