题目内容
某烃含氢元素的质量分数为17.2%,又测得该烃对空气的相对密度是2,求此烃的实验式和分子式.(保留计算过程)
考点:有机物实验式和分子式的确定
专题:计算题
分析:根据相对密度求出相对原子质量,再根据元素的质量分数来计算烃中原子的个数之比,求出实验式,然后求出物质的化学式.
解答:
解:该烃对空气的相对密度是2,即该烃的相对分子质量为2×29=58,某烃含氢元素的质量分数为17.2%,含碳则为82.8%,C和H的质量比为82.8:17.2,所以碳原子和氢原子个数比为:
:
=2:5,所以实验式为C2H5,分子式为(C2H5)n,即29n=58,解得n=2,所以分子式为C4H10,
答:此烃的实验式和分子式分别为:C2H5、C4H10.
| 82.8 |
| 12 |
| 17.2 |
| 1 |
答:此烃的实验式和分子式分别为:C2H5、C4H10.
点评:本题考查有机物分子式的确定,要确定某有机物的分子式,首先要判断其所含元素的种类,然后依据题目所给的条件确定有机物分子中各元素的原子数目,从而得到分子式.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
向Na2SO3和NaI的物质的量之比为1:1的混合溶液中逐滴滴入氯水,下列离子反应不可能发生的是( )
| A、SO32-+Cl2+H2O→SO42-+2H++2Cl- |
| B、4I-+SO32-+3Cl2+H2O→SO42-+2H++6Cl-+2I2 |
| C、2I-+SO32-+2Cl2+H2O→SO42-+2H++4Cl-+2I2 |
| D、2I-+2SO32-+3Cl2+2H2O→2SO42-+4H++6Cl-+I2 |
下列离子方程式书写正确的是( )
| A、向氧化铁中加入氢碘酸:Fe2O3+6H++2I-=2Fe2++I2+3H2O | ||||
| B、Cu片插入FeCl3溶液中:Cu+Fe3+═Fe2++Cu2+ | ||||
C、向Al2(SO4)3溶液中加入过量的氨水:Al3+4NH3?H2O═Al
| ||||
D、向NaHSO4溶液中滴加Ba(OH)2溶液至中性:H++S
|
能正确表示下列反应的离子反应方程式为( )
| A、明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
| B、NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2 H2O |
| C、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓ |
| D、醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
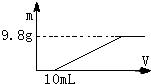 过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5mol?L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为( )
过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5mol?L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为( )| A、0.05mol |
| B、0.1mol |
| C、0.2mol |
| D、0.25mol |
 右图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,E、G在常温常压下是气体.
右图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,E、G在常温常压下是气体.