题目内容
3.常温下,将20g质量分数为14%的KNO3溶液与30g质量分数为24%的KNO3溶液混合,得到的密度为1.26 g/mL的混合溶液.计算:混合后溶液的质量分数.
混合后溶液的物质的量浓度.
分析 (1)分别计算出两溶液中含有溶质的质量,然后根据质量分数的公式计算;
(2)先根据溶液的质量与密度的关系计算溶液的体积,再根据溶液的质量与质量分数求出溶质的质量,继而求出溶质的物质的量,根据物质的量浓度公式求出溶液的物质的量浓度.
解答 解:(1)20.0g质量分数为14.0%的KNO3溶液中溶质的质量为:20.0g×14.0%=2.8g,
30.0g质量分数为24.0%的KNO3溶液中含有溶质的质量为:30.0g×24.0%=7.2g,
溶液混合前后溶质、溶液的质量都不变,所以混合液的质量分数为:$\frac{2.8g+7.2g}{20g+30g}$×100%=20%.
答:混合后溶液的质量分数为20%;
(2)混合液中溶质的质量为:2.8g+7.2g=10.0g,溶质的物质的量为:n=$\frac{10g}{101g/mol}$≈0.1mol,
溶液的体积为V=$\frac{20g+30g}{1.26g/mL}$≈40mL=0.04L,
所以溶液的物质的量浓度为:c=$\frac{n}{V}$=$\frac{0.1mol}{0.04L}$=2.5mol/L,
答:混合后溶液的物质的量浓度为2.5 mol/L.
点评 本题考查了物质的量浓度、溶质的质量分数的计算,题目难度中等,注意物质的量浓度、溶质的质量分数计算方法,该题是高考中的常见考点和题型,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
13.下列说法正确的是( )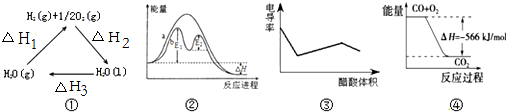

| A. | 图①中△H2=△H1+△H3 | |
| B. | 图②在催化剂条件下,反应的活化能等于E1+E2 | |
| C. | 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
14.下列溶液中,Cl-的物质的量浓度与50mL 3mol/LNaCl溶液中Cl-物质的量浓度不相等的是( )
| A. | 150mL 3mol/LKCl溶液 | B. | 150m L 1mol/LAlCl3溶液 | ||
| C. | 50mL3mol/LMgCl2溶液 | D. | 75mL 1.5mol/LMgCl2溶液 |
11.下列物质中,不属于合金的是( )
| A. | 硬铝 | B. | 黄铜 | C. | 钢铁 | D. | 金箔 |
18.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述正确的是( )
| A. | 植物油不能使溴水褪色 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质遇到硫酸铜后产生的沉淀能重新溶于水 |
8.甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(2)对于反应③,在相同温度和容积不变时,能说明该反应已达平衡状态的是BC
A.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3:1
D.容器内的密度保持不变.
| 化学反应 | 平衡 常数 | 温度/℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
(2)对于反应③,在相同温度和容积不变时,能说明该反应已达平衡状态的是BC
A.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3:1
D.容器内的密度保持不变.
15.根据能量变化示意图,下列热化学方程式正确的是( )
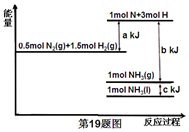

| A. | N2(g)+3H2(g)=2NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=-(a-b)kJ•mol-1 | |
| C. | 2NH3(1)=N2(g)+3H2(g)△H=2(a+b-c)kJ•mol-1 | |
| D. | 2NH3(1)=N2(g)+3H2(g)△H=2(b+c-a)kJ•mol-1 |
6.已知:I2+2S2O32═S4O62-+2I-.相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①CuCl2溶液与KI反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
②该试样中CuCl2•2H2O的质量百分数为95%.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①CuCl2溶液与KI反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
②该试样中CuCl2•2H2O的质量百分数为95%.