题目内容
14.下列溶液中,Cl-的物质的量浓度与50mL 3mol/LNaCl溶液中Cl-物质的量浓度不相等的是( )| A. | 150mL 3mol/LKCl溶液 | B. | 150m L 1mol/LAlCl3溶液 | ||
| C. | 50mL3mol/LMgCl2溶液 | D. | 75mL 1.5mol/LMgCl2溶液 |
分析 根据溶液中不水解的离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数进行计算氯离子的物质的量浓度,与溶液的体积无关,50mL 3mol/LNaCl溶液中Cl-物质的量浓度为3mol/L.
解答 解:A、150ml3mol/LKCl溶液中氯离子的物质的量浓度=3mol/L×1=3mol/L;
B、150mL1mol/LAlCl3溶液中氯离子的物质的量浓度=1mol/L×3=3mol/L;
C、50ml3mol/LMgCl2溶液中氯离子的物质的量浓度=3mol/L×2=6mol/L;
D、75mL 1.5mol/LMgCl2溶液中氯离子的物质的量浓度=1.5mol/L×2=3mol/L.
故选C.
点评 明确“溶液中不水解的离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数进行计算氯离子的物质的量浓度,与溶液的体积无关”是解本题的关键,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
2.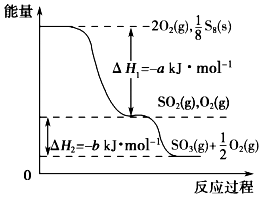 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )
 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )| A. | S8的燃烧热△H=-a kJ•mol-1 | |
| B. | 1 mol SO2和过量 O2反应可释放出 b kJ 的热量 | |
| C. | 已知1个S8分子中有8个S-S,S=O的键能为d kJ•mol-1,O=O的键能为e kJ•mol-1,则S8分子中S-S的键能为(2d-a-e) kJ•mol-1 | |
| D. | 若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ |
9.下列物质的分类合理的是( )
| A. | 氧化物:CO2、NO、SO2、H2O | B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | ||
| C. | 铵盐:NH4Cl、NH4NO3、NH3•H2O | D. | 碱性氧化物:Na2O、CaO、CO2、Al2O3 |
6.已知1gN2含a个分子,则阿伏加德罗常数为( )
| A. | $\frac{a}{14}$ mol-1 | B. | $\frac{a}{28}$ mol-1 | C. | 14a mol-1 | D. | 28a mol-1 |
4.浓度均为0.1mol•L-1的下列各组溶液,pH前者大于后者的是( )
| A. | NaH2PO4、Na2HPO4 | B. | Na2CO3、NaHCO3 | C. | NaHSO4、NaHCO3 | D. | Na2SO4、CH3COONa |

 .
.