题目内容
1.(1)金属钠切开后,光亮的金属表面变暗,说明常温下钠能够跟氧气反应,生成氧化钠;钠投入水中,钠浮水面上,并四处游动,发出响声,这说明有气体生成,熔成一个闪亮的小球,说明钠的熔点很低,最后向烧杯中滴加酚酞,溶液变红色反应的化学方程式为:2Na+2H2O═2NaOH+H2↑.(2)将一小块金属钠投入到FeCl3溶液中,此时观察到的现象是浮于水面四处游动、熔成小球,有嘶嘶响声,有气体产生,有红褐色沉淀生成,有关化学反应方程式是2Na+2H2O=2NaOH+H2↑,FeCl3+3NaOH=Fe(OH)3↓+3NaCl.
分析 (1)钠是很活泼的金属,在无条件下就能与氧气反应,所以在自然界中只能以 化合态存在;观察切开面,新切开的金属钠断面呈 银白色色,钠在无条件下就能与氧气反应生成氧化钠,所以在空气中很快变暗色,钠密度小于水,熔点低和水反应生成氢氧化钠溶液和氢气;
(2)钠投入氯化铁溶液,钠先与水反应生成氢氧化钠和氢气,氢氧化钠再与氯化铁发生复分解反应生成氢氧化铁沉淀,据此解答.
解答 解:(1)金属钠切开后,光亮的金属断面很快变暗色,说明常温下钠和空气中的氧气反应生成白色固体氧化钠,钠投入水中浮水面乱游动,嘶嘶响说明钠密度小于水,反应过程中生成气体,钠熔点低,反应放热熔成一个闪亮的小球,最后向烧杯中滴加酚酞,溶液变红色,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:变暗;氧气;氧化钠;浮;反应生成气体;钠的熔点低;红色;2Na+2H2O=2NaOH+H2↑;
(2)钠投入氯化铁溶液,钠先与水反应生成氢氧化钠和氢气,化学方程式:2Na+2H2O=2NaOH+H2↑,氢氧化钠再与氯化铁发生复分解反应生成氢氧化铁红褐色沉淀,方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl,现象为:浮于水面四处游动、熔成小球,有嘶嘶响声,有气体产生,有红褐色沉淀生成;
故答案为:浮于水面四处游动、熔成小球,有嘶嘶响声,有气体产生,有红褐色沉淀生成;2Na+2H2O=2NaOH+H2↑,FeCl3+3NaOH=Fe(OH)3↓+3NaCl.
点评 本题考查的是钠的物理性质、化学性质,通过阅读教材即可得出答案,属基础题.碱金属是典型金属元素的代表,钠是碱金属元素的代表,在无机化学中有非常重要的地位,因而成为命题的重点物质,是物质推断、鉴别、及有关实验、计算的常见物质.

练习册系列答案
相关题目
20.铁粉和水蒸气反应的装置如图所示,有关该反应的说法正确的是( )
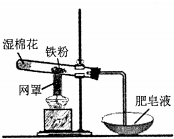

| A. | 该反应属于复分解反应 | |
| B. | 网罩的作用是集中火焰,提高温度 | |
| C. | 湿棉花的作用是给试管降温,防止炸裂 | |
| D. | 反应中水既不是氧化剂,也不是还原剂 |
9.对于反应3X(g)+Y(g)?Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:增大;
(2)增大压强:增大;
(3)增大容器容积:减小.
(1)升高温度:增大;
(2)增大压强:增大;
(3)增大容器容积:减小.
6.下列叙述正确的是( )
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | 用pH试纸测溶液的pH时,需先用蒸馏水润湿试纸 | |
| C. | 0.2 mol/L的盐酸与等体积水混合后pH约为1 | |
| D. | 25℃时,pH=12的氨水溶液与pH=2的盐酸等体积混合后pH=7 |