题目内容
16.已知X、Y、Z、W、M五种元素,X、Z、W在元素周期表位置如下周期表,①ZX4++WX-$\frac{\underline{\;\;△\;\;}}{\;}$ZX3+X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW
分子中质子数相等.回答下列问题:
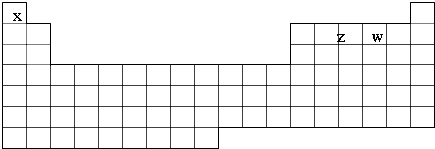
(1)在周期表中写出M,Y的元素符号;
(2)写出ZX3的化学键类型:极性键;
(3)写出M单质与NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)M的最高价氧化物对应水化物与Z的最高价氧化物对应的水化物反应的化学方程式为:Al(OH)3+3 HNO3=Al(NO3)3+3H2O.
分析 X、Y、Z、W、M五种短周期元素,原子序数依次增大.根据元素在周期表中的相对位置可知,X是H,Z是N,W是O.根据ZX4++WX-═ZX3+X2W可知,则ZX4+为NH4+,WX-为OH-,ZX3为NH3,X2W为H2O.M3+电子数与NH4+、OH-、NH3、H2O相等,则M为Al元素.由于Z2与YW分子(YW分子为CO)中质子数相等则Y为C元素,则Y原子质子数为7×2-8=6,故Y为C元素,据此解答.
解答 解:X、Y、Z、W、M五种短周期元素,原子序数依次增大.根据元素在周期表中的相对位置可知,X是H,Z是N,W是O.根据ZX4++WX-═ZX3+X2W可知,则ZX4+为NH4+,WX-为OH-,ZX3为NH3,X2W为H2O.M3+电子数与NH4+、OH-、NH3、H2O相等,则M为Al元素.由于Z2与YW分子(YW分子为CO)中质子数相等则Y为C元素,则Y原子质子数为7×2-8=6,故Y为C元素.
(1)M为Al元素,处于第三周期ⅢA则,Y为碳元素,处于周期表中第二周期ⅣA族,在周期表位置为: ,
,
故答案为: ;
;
(2)NH3分子中的化学键是极性键,故答案为:极性键;
(3)金属铝能和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)M的最高价氧化物对应水化物与Z的最高价氧化物对应的水化物反应分别是氢氧化铝和硝酸,氢氧化铝是两性氢氧化物,和硝酸反应的化学方程式是:Al(OH)3+3 HNO3=Al(NO3)3+3H2O,
故答案为:Al(OH)3+3 HNO3=Al(NO3)3+3H2O.
点评 本题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度.考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力.试题基础性强,注重能力的培养,侧重对基础知识的巩固与检验.

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案| A. | 1.0×l0-5 mo1•L-1盐酸的pH=5,将其稀释1000倍后pH=8 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 次氯酸钠溶液中离子浓度:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 由0.1 mo1•L-1一元酸HA溶液的pH=3,则其Ka=10-2 mo1•L-1 |
| A. | AlCl3和KOH | B. | Na2CO3和盐酸 | C. | Na[Al(OH)4]和盐酸 | D. | AlCl3和氨水 |
| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 过量的NaHSO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | NaHCO3和过量NaOH溶液相混合:HCO3-+OH-═CO32-+H2O | |
| C. | NaHSO4溶液中滴加NaHCO3溶液:H++HCO3-═H2O+CO2↑ | |
| D. | 用NaOH吸收过量的CO2:CO2+OH-═HCO3- |

 ,名称是苯乙炔;
,名称是苯乙炔;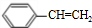 +Br2→
+Br2→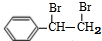 ;
;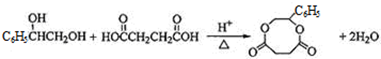 ;
; .
.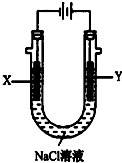 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.