题目内容
20.铁粉和水蒸气反应的装置如图所示,有关该反应的说法正确的是( )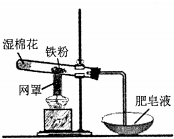
| A. | 该反应属于复分解反应 | |
| B. | 网罩的作用是集中火焰,提高温度 | |
| C. | 湿棉花的作用是给试管降温,防止炸裂 | |
| D. | 反应中水既不是氧化剂,也不是还原剂 |
分析 试管中发生3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,Fe元素的化合价升高,H元素的化合价降低,湿棉花可提供水蒸气,以此来解答.
解答 解:试管中发生3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
A.反应物、生成物中均有单质,不属于复分解反应,故A错误;
B.网罩的作用是集中火焰,提高温度,提供反应需要的能量,故B正确;
C.湿棉花可提供水蒸气,水蒸气为反应物,故C错误;
D.水中H元素的化合价降低,则水为氧化剂,故D错误;
故选B.
点评 本题考查铁的化学性质及氧化还原反应,为高频考点,把握发生的反应及现象为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
11.下列叙述正确的是( )
| A. | 某元素由化合态变为游离态时,该元素一定被还原 | |
| B. | 金属阳离子被还原不一定得到金属单质 | |
| C. | 生成非金属单质的反应一定是氧化反应 | |
| D. | 在氧化还原反应中,非金属单质一定是氧化剂 |
8.下列离子方程式正确的是( )
| A. | 稀硝酸与足量的Fe反应的离子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 碳酸氢钙溶液中加入过量的氢氧化钠:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向碳酸钙中加入稀盐酸的离子方程式:CO32-+2H+═CO2↑+H2O | |
| D. | 硅酸钠溶液中通入过量二氧化碳:CO2+SiO32-+H2O═H4SiO4↓+CO32- |
15.25℃的水溶液中,下列说法正确的是( )
| A. | 1.0×l0-5 mo1•L-1盐酸的pH=5,将其稀释1000倍后pH=8 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 次氯酸钠溶液中离子浓度:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 由0.1 mo1•L-1一元酸HA溶液的pH=3,则其Ka=10-2 mo1•L-1 |
12.下列各组物质中,所含分子数相同的是( )
| A. | 10gH2和10gO2 | B. | 11.2LN2(标准状况下)和11gCO | ||
| C. | 9gH2O和0.5mol Br2 | D. | 224mlH2(标准状况下)和0.1mol N2 |
9.设NA为阿伏加德罗常数,则下列叙述正确的是( )
| A. | 标准状况下,2.24 CCl4中含有0.4NA个碳氯单键 | |
| B. | 22.4LCl2通入水中充分反应,共转移NA个电子 | |
| C. | 1 L 1 mol/L的氯化铜溶液中Cu2+的数目小于NA | |
| D. | 5.6g铁在0.1 mol氯气中充分燃烧,转移的电子数为0.3NA |